
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Отдельные представители (самостоятельно)
|
|
Нитрометан, нитроэтан, нитропропан, нитробутаны.
Получаются в технике нитрованием газообразных парафинов.
Применение:
1. Компоненты реактивного топлива.
2. Растворители эфиров целлюлозы и виниловых спиртов.
3. Получение вулканизационных агентов.
4. Получение ВВ
5. Получение пластификаторов
6. Получение эмульгаторов и фармацевтических препаратов (из нитроолефинов).
ЛЕКЦИЯ 14
АМИНЫ
Определение и классификация
Это производные углеводородов, у которых один или несколько атомов водорода замещены остатками аммиака (аминогруппами).
Классифицируются:
1) по количеству радикалов, связанных с аминогруппой:
а) первичные амины R-NH2
б) вторичные амины R-NH-R
в) третичные амины R
N-R
R
2) по количеству аминогрупп
а) моноамины
б) полиамины (диамины, триамины и т.д.)
Изомерия, номенклатура
Кроме изомерии цепи и изомерии положения, амины жирного ряда имеют третий вид структурной изомерии – метамерию.
| CH3NH2 | Изомеров не имеет |
| CH3-CH2-NH2 CH3-NH-CH3 | Метамеры |
| CH3-CH2-CH2-NH2 CH3-CH2NH-CH3 CH3 N-CH3 CH3 | Метамеры |
| CH3-CH2-CH2-CH2-NH2 CH3-CH-CH2-NH2 CH3 | Изомерия цепи |
| CH3-CH-CH3 NH2 | Изомеры положения |
Номенклатура
1. Систематическая радикально-функциональная – перечисляются радикалы и добавляется слово “амин” (или диамин – если две аминогруппы) и т.д.
(CH3-CH2-)3N H2N-CH2-CH2-NH2
триэтиламин этилендиамин
2. Систематическая заместительная – берется за основу название углеводорода, к которому добавляется приставка “ амино”. Нумерация со стороны аминогруппы.
1 2 3 4 5 6
CH2-CH-CH2-CH2-CH-CH3
NH2 CH3 NH2
1,5-диамино-2-метилгексан
Получение
1. Взаимодействие галогеналкилов с аммиаком и аминами
CH3-I + NH3  [CH3N+H3]I-
[CH3N+H3]I-  CH3NH2
CH3NH2
Йодистый -NH4I
метиламмоний
При избытке галогеналкила реакция идет дальше.
CH3-NH2 + CH3I  CH3-NH-CH3
CH3-NH-CH3  CH3-N-CH3 + NH4I
CH3-N-CH3 + NH4I
-NH4I +NH3 CH3
(CH3)3N: + CH3I  [(CH3)4N+]I-
[(CH3)4N+]I-
Йодистый тетраметиламмоний
(полностью замещенная аммониевая соль)
2. Действие гипохлорита на амиды кислот (реакция Гофмана)
O
CH3-C + NaOCl  CO2 + NaCl + CH3NH2
CO2 + NaCl + CH3NH2
NH2
3. Восстановление нитросоединений (см. свойства нитросоединений)
4. Восстановление нитрилов кислот и изонитрилов
CH3-C  N + 4H
N + 4H  CH3-CH2-NH2
CH3-CH2-NH2
Физические свойства
Бесцветные вещества с непприятным запахом. Метиламин, диметиламин и триметиламин – газы с запахом NH3, остальные жижкие и твердые вещества. В воде растворимы, образуют с водой водородные связи, при растворении взаимодействуют с водой.
Химические свойства
I. Проявляют свойства оснований.
1) Присоединяют молекулу воды с образованием гидроксидов, способных диссоциировать на ионы.
CH3NH2 + HOH  [CH3N+H3]OH
[CH3N+H3]OH
Гидроксид метиламмония
Степень диссоциации гидроксидов зависит от влияния радикала. Основность аминов выше, чем у аммиака, т.к. положительный индукционный эффект радикалов увеличивает электронную плотность на азоте.
| Формула | К диссоциации гидроксида |
| [NH4]OH | 2.10-5 |
| [CH3-N+H2]OH- | 4,4.10-4 |
| [(CH3)2N+H2]OH- | 5,5.10-4 |
| [(CH3)4N+]OH- | Гидроксид тетраметиламмония – четвертичное основание – диссоциирует полностью (аналогично щелочам) |
2) Образование солей
C4H9-NH2 + H+O-SO2OH  [C4H9N+H3]O-SO2OH
[C4H9N+H3]O-SO2OH
бисульфат бутиламмония
O O
CH3-NH2 + H+-O--C-CH3  [CH3-N+H3]O--C-CH3
[CH3-N+H3]O--C-CH3
метиламин уксуснокислый
II. Атом водорода в аминогруппе обладает большой подвижностью, т.к. связь N 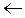 Н полярна.
Н полярна.
1) Он легко замещается на алкилы и на ацилы
а) Алкилирование аминов осуществляется действием галогеналкилов, спиртов, диалкилсульфатов.
C2H5
CH3NH2 + C2H5Br  CH3-NH . HBr
CH3-NH . HBr
Метилэтиламин бромистоводородный
б) ацилирование аминов проводится действием кислот, их хлорангидридов или ангидридов. Образуются N-замещенные амиды.
O
CH3-C O
C2H5NH2 + O  C2H5NH-C-CH3 + CH3-C
C2H5NH-C-CH3 + CH3-C
CH3-C O OH
O
N-этилацетамид
CH3 O CH3
NH + CH3-C  CH3-C-N
CH3-C-N
CH3 Cl O CH3
N,N-диметилацетамид
2) Взаимодействие с азотистой кислотой
а) первичные амины образуют спирты
CH3-NH2+HO-N=O  CH3-NH-N=O
CH3-NH-N=O  CH3-N=N-OH
CH3-N=N-OH  N2 + CH3OH
N2 + CH3OH
N-нитрозометиламин метилдиазогидрат
б) вторичные амины образуют только нитрозоамины
CH3 CH3
NH + HO-N=O  N=N=O
N=N=O
CH3 CH3
третичные амины образуют соли азотистой кислоты
(CH3)3N + H+O-N=O  [(CH3)3N+H]O--N=O
[(CH3)3N+H]O--N=O
3) Превращение первичных аминов в изонитрилы
Cl KOH
CH3NH2 + H-C-Cl + KOH  CH3-N+
CH3-N+  C- + 3KCl + 3H2O
C- + 3KCl + 3H2O
Cl KOH
Характерная реакция на первичные амины
III. Окисление аминов
Амины очень легко окисляются
1) Окисление первичных жирных аминов
CH3NH2+O2+H2NCH3  CH3-N=N-CH3
CH3-N=N-CH3  2CH3N=O
2CH3N=O 
 2CH3NO2
2CH3NO2
нитрометан
2) Окисление вторичных жирных аминов
(CH3)2NH + O + HN(CH3)2  (CH3)2N-N(CH3)2
(CH3)2N-N(CH3)2
тетраметилгидразин
3) Окисление третичных аминов
(CH3)3N: + O:  (CH3)3N+
(CH3)3N+  O-
O-
окись амина
Применение
Амины жирного ряда используются в качестве антиоксидантов, флотационных агентов, при изготовлении моющих средств. Диамины применяются для получения полимеров типа полиамидов (например, найлона – сополимера на основе гексаметилендиамина и адипиновой кислоты).
ЛЕКЦИЯ 15
|
Просмотров 645 |
|
|
