
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

А) Диссоциация в водном растворе
|
|
O O
R-C  R-C + H+
R-C + H+
O-H O-
По степени диссоциации – это слабые кислоты. Наиболее сильная – муравьиная кислота. У других кислот углеводородный радикал, обладающий электродонорными свойствами, отталкивает электроны к водороду (положительный индукционный эффект), и кислотность снижается.
HCOOH Кд=2,14.10-4
CH3  C
C  O
O  H Кд=1,75.10-5
H Кд=1,75.10-5
О
Степень диссоциации увеличивается при введении в радикал электроноакцепторных групп, например, групп С=О, ОН, Cl. Чем ближе эти группы расположены к СООН, тем сильнее кислота. Например, у хлоруксусной кислоты
Cl 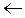 CH2
CH2 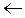 C
C 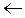 OH Кд=1,5.10-3
OH Кд=1,5.10-3
О
у трихлоруксусной
Cl
Cl 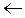 C
C  C-O-H Кд=2,1.10-1
C-O-H Кд=2,1.10-1
Cl
т.е. трихлоруксусная кислота аналогична сильным минеральным кислотам.
2) Образование солей происходит при взаимодействии с металлами, окисями, гидроокисями металлов, с некоторыми другими солями и аммиаком
а) 2HCOOH + Mg  H2 + (HCOO)2Mg
H2 + (HCOO)2Mg
формиат магния
б) 2СH3COOH + CaO  (CH3COO)2Ca + H2O
(CH3COO)2Ca + H2O
ацетат кальция
в) С2H5COOH + NaOH  H2O + C2H5COONa
H2O + C2H5COONa
пропионат натрия
г) CH3COOH + NaHCO3  CH3COONa + CO2 + H2O
CH3COONa + CO2 + H2O
д) CH3COONa + AgNO3  CH3COOAg + NaNO3
CH3COOAg + NaNO3
е) CH3COOH + NH3  [CH3COO-]N+H4
[CH3COO-]N+H4
3) Образование производных карбоновых кислот путем замещения гидроксила (реакции ацилирования)
А) Образование хлорангидридов кислот
O O
CH3-C + PCl5  CH3-C + POCl3 + HCl
CH3-C + POCl3 + HCl
OH Cl
(или PCl3 хлорангидрид уксусной кислоты
SOCl2) (хлористый ацетил)
Б) Образование амидов карбоновых кислот
O O
CH3-C + NH3  CH3-C + H2O
CH3-C + H2O
OH NH2
O O
CH3-C + NH3  CH3-C + HCl
CH3-C + HCl  NH4Cl
NH4Cl
Cl NH2
в) Образование сложных эфиров со спиртами (см. свойства спиртов)
Дегидратация кислот
O O
CH3-C CH3-C
OH O
OH  H2O + CH3-C
H2O + CH3-C
CH3-C Kat O
O
ангидрид уксусной кислоты
Реакция требует очень высокой температуры, поэтому чаще ангидриды кислот получают взаимодействием солей с хлорангидридами.
O O
CH3-C CH3-C
ONa  NaCl + O
NaCl + O
Cl CH3-C
CH3-C O
O
5) Декарбоксилирование – отщепление СО2.
У предельных одноосновных кислот идет трудно и требует высокой температуры и присутствия щелочи. В результате образуется углеводород.
O
CH3-C + NaOH  Na2CO3 + CH4
Na2CO3 + CH4 
ONa
6) Окисление.
Предельные одноосновные кислоты к окислению устойчивы, за исключением муравьиной кислоты, которая проявляет свойства альдегидов.
O O
H-C + O  HO-C-OH
HO-C-OH  CO2 + H2O
CO2 + H2O
H
7) Реакции в радикале.
O O
CH3-C + Cl2  ClCH2-C
ClCH2-C
OH OH
ЛЕКЦИЯ 12
ПРЕДЕЛЬНЫЕ ДВУХОСНОВНЫЕ КИСЛОТЫ
| HOOC-COOH | щавелевая | этандионовая |
| HOOC-CH2-COOH | малоновая | пропандионовая |
| HOOC-CH2-CH2-COOH | янтарная | и т.д. |
| OOC-(CH2)3-COOH | глутаровая | |
| OOC-(CH2)4-COOH | адипиновая |
Отличие в свойствах
1. Кислотные свойства более сильные. Степень диссоциации тем выше, чем ближе две группы СООН.
К1 щавелевая = 3,8.10-2
К1 адипиновая = 3,9.10-5
2. Образуют кислые и средние соли, полные и неполные амиды, хлорангидриды, сложные эфиры.
3. Неустойчивы к нагреванию - разлагаются
а) щавелевая и малеиновая кислоты отщепляют СО2 (декарбоксилируются) с образованием одноосновных кислот.
HOOC-COOH  CO2 + HCOOH
CO2 + HCOOH
б) янтарная и глутаровая кислоты образуют циклические ангидриды
O O
CH2-C CH2-C
OH O
OH  H2O + CH2-C
H2O + CH2-C
CH2-C O
O
в) адипиновая кислота и следующие при нагревании отщепляют и СО2, и воду, образуя циклические кетоны.
O
CH2-CH2-C
OH CH2-CH2
OH  CO2 + H2O + C=O
CO2 + H2O + C=O
CH2-CH2-C CH2-CH2
O циклопентанон
Реакция идет легче, если взять кальциевую соль кислоты (выделяется СаСО3).
4. Двухосновные кислоты, в отличие от одноосновных, могут окисляться.
 O CO2
O CO2
 HO-C=O
HO-C=O  CO2 + HO-C
CO2 + HO-C
HO-C=O OH H2O
5. Малоновая кислота отличается особой подвижностью атомов водорода в метиленовом мостике. Н – приобретает способность замещаться. Например, диэтиловый эфир малоновой кислоты при действии металлического натрия дает замещение Н на Na.
+  H +
H + 
HOOC  C
C  COOH
COOH
H
O O
C C
OC2H5 OC2H5
CH2 + 2Na  H2
H2  + 2 CHNa
+ 2 CHNa
O O
C C
OC2H5 OC2H5
натриймалоновый эфир
На его основе получают различные кислоты, например,
COOC2H5 COOC2H5
CHNa + Br-CH2-CH3  NaBr + CH-CH2-CH3
NaBr + CH-CH2-CH3 
COOC2H5 COOC2H5 -2C2H5OH
O
C
OH
 CH-CH2-CH3
CH-CH2-CH3  CO2 + CH3-CH2-CH2-COOH
CO2 + CH3-CH2-CH2-COOH
O масляная кислота
C
OH
6. Поликонденсация двухосновных кислот с двухатомными спиртами и диаминами
O O O O
nC-(CH2)4-C +n HO-CH2-CH2-OH  n H2O + (-C-(CH2)4-C-O-CH2-CH2-O-)n
n H2O + (-C-(CH2)4-C-O-CH2-CH2-O-)n
HO OH
адипиновая килота этиленгликоль этиленгликольадипинат
O O O O
nC-(CH2)4-C + nH2N-(CH2)6-NH2  nH2O + (-C-(CH2)4-C-NH-(CH2)6-NH-)n
nH2O + (-C-(CH2)4-C-NH-(CH2)6-NH-)n
HO OH
полиамиды (найлон 66)
Непредельные кислоты
Одноосновные
| O CH2=CH-C OH | Акриловая, пропеновая |
| O CH2=CH-C CH3 OH | Метакриловая |
| O CH3-CH=CH-C OH | Кротоновая (имеет цис- и транс-изомеры) |
Двухосновные
| HO O C-CH2=CH-C O OH | Простейшая бутендиовая (существует в виде двух геометрических изомеров) |
| O H-C-C OH OH H-C-C O | Цис-изомер малеиновая |
| O H-C-C O OH C-C-H HO | Транс-изомер фумаровая кислота |
Отличия в свойствах
1) Обладают более сильными кислотными свойствами, если двойная связь расположена через одну простую от группы СООН (т.к. углерод в состоянии sp2-гибридизации обладает более высокой электроотрицательностью.)
2) Дают реакции двойных связей
а) присоединения (причем у кислот с сопряженным положением двойной связи – не по правилу Марковникова);
б) окисления – с разрывом двойной связи;
в) полимеризации.
Полимеры непредельных кислот и их производных имеют большое практическое применение. Так, нитрил акриловой кислоты используется для получения полиакрилонитрила – волокна нитрон.
-(CH2-CH-)n-
C  N
N
Полимерные эфиры акриловой кислоты – стеклообразные массы. Полиметилметакрилат (плексиглаз) получают, исходя из ацетона, HCN и CH3OH.
O OH
CH3-C + HCN  CH3-C-C
CH3-C-C  N
N  CH2=C-C
CH2=C-C  N
N 
CH3 CH3 -H2O CH3
OH O O
 CH2=C-C=NH
CH2=C-C=NH  CH2=C-C
CH2=C-C  nCH2=C-C
nCH2=C-C  (-CH2-C-)n
(-CH2-C-)n
CH3 NH2 –NH3 OCH3 C=O
OCH3
ПММА
3) У геометрических изомеров непредельных карбоновых кислот ярко выражена зависимость взаимного влияния групп от их пространственного расположения.
Так, цис- и транс-изомеры бутендиовой кислоты (малеиновая и фумаровая кислоты) очень сильно отличаются и по физическим, и по химическим свойствам.
Малеиновая кислота
Цис-изомер – менее устойчив, в природе не встречается. Тпл=1300С. Хорошо растворима в воде. К1=1,5.10-2, К2=1,3.10-6. Хорошо растворима в воде. К1=1,5.10-2, К2=1,3.10-6. Легко отщепляет воду и образует малеиновый ангидрид.
O O
H-С-С H-C-C
OH O
OH  H2O + H-C-C
H2O + H-C-C
H-C-C O
O
Фумаровая кислота
Транс-изомер – устойчива, встречается в грибах. Тпл=2870С, плохо растворима в воде, К1=1.10-3, К2=3.10-5. Фумарового ангидрида не образуется. При сильном нагревании (3000С) образуется малеиновый ангидрид.
O O
H-C-C H-C-C
O OH  O
O
C-C-H -H2O H-C-C
HO O
В результате реакций присоединения малеиновая и фумаровая кислоты образуют одни и те же вещества. Например,
O
H-C-C
OH O O H-C-COOH
OH + Br2  HO-C-CH-CH-C-OH
HO-C-CH-CH-C-OH  Br2 +
Br2 +
H-C-C Br Br HOOC-C-H
O
Малеиновая кислота  ,
,  /-дибромянтарная кислота фумаровая кислота
/-дибромянтарная кислота фумаровая кислота
Сравнивая различия в свойствах малеиновой и фумаровой кислот, можно сформулировать основные особенности геометрической изомерии.
|
Просмотров 1169 |
|
|
