
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Предельные одноосновные кислоты. Гомологический ряд
|
|
Общая формула СnH2n+1COOH
| Эмпирическое название | кислот | солей, эфиров |
| O H-C OH | муравьиная | формиат |
| O CH3-C OH | уксусная | ацетат |
| CH3-CH2-COOH | пропионовая | пропианат |
| CH3-CH2-CH2-COOH | масляная | бутират |
| O CH3-CH-C CH3 OH | изомасляная | бутират |
| CH3-(CH2)3-COOH | валериановая | валеронат |
| CH3-(CH2)4-COOH | капроновая | капронат |
Изомерия
Наблюдается, начиная с четвертого члена ряда:
O
СH3-CH-C (изомерия цепи) – изомасляная кислота
CH3 OH
Номенклатура
Рациональная номенклатура
Соединения рассматриваются как продукты замещения атомов водорода в уксусной кислоте радиалами.
CH3 O
CH3-C-C триметилуксусная кислота
CH3 OH
Систематическая (IUPAC)
За основу принимается самая длинная цепь, включающая группу СООН. Нумерация производится от группы СООН. К названию углеводорода, соответствующего самой длинной цепи, добавляется окончание “-овая” кислота.
5 4 3 2 1 O
СH3-CH-CH2-CH2-C 4-метилпентановая кислота
CH3 OH
Карбоксильная группа обозначается приставкой “карбоксиалкил”.
8 7 6 5 4 3 2 1
HOOC-CH2-CH2-CH2-CH-CH2-CH2-COOH 4-карбоксиметилоктандионовая
CH2-COOH кислота
Способы получения
Окисление углеводородов
а) Окисление предельных углеводородов С20-С40(см. свойства парафинов);
Б) Окисление олефинов
R-C=O
OH
R-CH=CH-R + 4O 
R-C=O
OH
2. Окисление первичных спиртов и альдегидов (см. свойства спиртов и альдегидов)
Омыление нитрилов
OH O O
CH3I+KCN  KI+CH3-C
KI+CH3-C  N
N  CH3-C=NH
CH3-C=NH  CH3-C
CH3-C  CH3-C
CH3-C
NH2 –NH3 OH
Магний-органический синтез
C=O
O O O
СH3I + Mg  CH3-Mg
CH3-Mg  CH3-C
CH3-C  Mg(OH)I + CH3-C
Mg(OH)I + CH3-C
OMg OH
Оксосинтез
СH2=CH2 + C=O + HOH 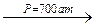 СH3-CH2-C=O
СH3-CH2-C=O
H3PO4 OH
Гидролиз гемитригалогенопроизводных
Cl OH O O
СH3-C-Cl + HOH  CH3-C-Cl
CH3-C-Cl  CH3-C
CH3-C  CH3-C
CH3-C
Cl Cl Cl OH
Электронное строение
В карбоксильной группе электроная плотность, благодаря наличию Р-сопряжения, смещена в сторону карбонильного кислорода, в результате повышается полярность связи О-Н.
- 
H H +  O
O
H-C-C  C
C
H H O-H
Кроме того, группа СООН, имея на углероде заряд +  , оказывает индукционное влияние на радикал, увеличивая заряд +
, оказывает индукционное влияние на радикал, увеличивая заряд +  у атомов водорода в
у атомов водорода в  -положении.
-положении.
При диссоциации карбоновых кислот образуется карбоксилат-анион, у которого обе связи с кислородами совершенно равноценны.
O O- O- O-1/2
R-C  R-C R-C R-C
R-C R-C R-C
O- O O O-1/2
Физические свойства предельных одноосновных карбоновых кислот
Первые три члена ряда С-С3 – подвижные бесцветные жидкости со жгучим запахом, смешиваются с водой. С4 и далее – маслянистые жидкости с запахом прогорклого масла, с водой не смешиваются, ратсворимость уменьшается с увеличением молекулярного веса. Неустойчивы к нагреванию. С1-С9 – жидкости; С10 и более – твердые вещества. Температуры кипения кислот высокие. У муравьиной кислоты – 1000С, дальше – еще выше. Это объясняется тем, что карбоновые кислоты образуют за счет водородных связей димеры, сохраняющиеся даже при кипении.
O…….H-O
СH3-C C-CH3
O-H…….O
Химические свойства карбоновых кислот
Кислотные свойства
|
Просмотров 1293 |
|
|
