
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Способы получения (кроме общих)
|
|
1. Из олефинов


 СH2-CH2
СH2-CH2  CH2-CH2
CH2-CH2
O OH OH
окись этилена
 СH2=CH2
СH2=CH2  CH2-CH2
CH2-CH2  CH2-CH2
CH2-CH2
OH Cl -HCl OH OH
этиленхлоргидрин
 СH2-CH2
СH2-CH2  CH2-CH2
CH2-CH2
Cl Cl 2HCl OH OH
дихлорэтилен
2. Из ацетилена (см. свойства ацетилена)
O=CH2 + CH  CH + CH2=O
CH + CH2=O  CH2-C
CH2-C  C-CH2
C-CH2  CH2-CH2-CH2-CH2
CH2-CH2-CH2-CH2
OH OH OH OH
бутиндиол 1,2-бутиленгликоль
3. Из природных веществ
а) гидролиз жиров – глицерин;
б) восстановление моносахаридов – эритриты, пентиты, гекситы.
Физические свойства
Гликоли и глицерины – густые сиропообразные жидкости с очень высокими Ткип (200-3000С), очень гигроскопичны.
Тетриты – гекситы – твердые бесцветные кристаллические вещества. Хорошо растворимы в воде, обладают сладким вкусом, усваиваются организмом.
Химические свойства
1) обладают более сильными кислотными свойствами, чем одноатомные спирты. Образуют комплексные алкоголяты с Cu(OH)2. При этом голубой осадок Сu(OH)2 растворяется в многоатомном спирте с образованием синего раствора (качественная реакция на многоатомные спирты):
H
CH2OH HO-CH2 CH2-O O-CH2
.. +HO-Cu-OH +  2H2O + Cu
2H2O + Cu
CH2OH HO-CH2 CH2-O O-CH2
H
гликолят меди синего цвета
2) способны к образованию циклических простых эфиров
а) СH2-CH2
OH OH CH2-CH2
OH OH 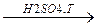 2H2O + O O
2H2O + O O
CH2-CH2 CH2-CH2
Диоксан
б) СH2-CH2 CH2-CH2
CH2 CH2  H2O + CH2 CH2
H2O + CH2 CH2
OH OH O
1,4-бутандиол тетрагидрофуран
в) СH2-CH2  H2O + CH2-CH2
H2O + CH2-CH2
OH OH O
Последняя реакция идет трудно, поэтому практически используются косвенные методы.
3) Образуют простые эфиры открытого строения
а) HO-CH2-CH2-OH + CH2-CH2  HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
O диэтиленгликоль
б) сложные эфиры
 O CH2-CH2 CH2 CH2 CH2-CH2
O CH2-CH2 CH2 CH2 CH2-CH2
СH3-C +  O-C-CH3 OH
O-C-CH3 OH  O O
O O
OH HO OH O -H2O C=O C=O
CH3 CH3
диацетат гликоля
СН2OH CH2ONO2
CHOH + 3HONO2  CHONO2
CHONO2
CH2OH CH2ONO2
тринитрат глицерина
(тринитроглицерин)
4) Реакции окисления протекают ступенчато:
O O O O
СH2-OH C C C C
H OH OH OH




O O
CH2-OH CH2OH CH2OH C C
H OH
5) Реакции замещения группы ОН идут также ступенчато, в результате образуются полные и неполные производные:
CH2OH CH2-Cl
CHCl  CH-Cl
CH-Cl
CH2OH CH2OH CH2-OH CH2Cl
CHOH 
 -монохлоргидрин
-монохлоргидрин  СHCl
СHCl
CH2OH -H2O СH2Cl CH2Cl -H2O CH2Cl
CHOH  CHOH трихлоргидрин
CHOH трихлоргидрин
CH2OH -H2O CH2Cl
 -монохлоргидрин дихлоргидрин
-монохлоргидрин дихлоргидрин
глицерина глицерина
ЛЕКЦИЯ 9
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Кислородные соединения, содержащие в составе группу С=О. В зависимости от того, с чем связана эта группа, они делятся на альдегиды
O и кетоны R-C-R
R-C O
H
Классификация
1) по рядам углеводородов – предельные и непредельные;
2) по количеству карбонильных групп – моноальдегиды, монокетоны,
диальдегиды, дикетоны
Гомологический ряд предельных альдегидов
О
H-C муравьиный метаналь
Н
О
СH3-C уксусный этаналь
Н
О
СH3-CH2-C пропионовый пропаналь
Н
O
CH3-CH2-CH2-C масляный бутаналь
H
O
CH3-CH-C изомасляный 2-метил-1-пропаналь (сист.)
CH3 H диметилуксусный альдегид (рац.)
O
C4H9-C валериановый (названия по соответствующим кислотам)
H
Начиная с масляного альдегида дают структурную изомерию – изомерию цепи. Более сложные альдегиды дают также изомерию положения.
Рациональная система названий
За основу принимается первый типический член ряда – уксусный альдегид. Например, диметилуксусный альдегид.
Номенклатура IUPAC
За основу принимается полное название соответствующего углеводорода, к которому добавляется окончание –АЛЬ, нумерация с углерода карбоновой группы.
O
CH3-CH2-CH-CH2-C 3-метил-1-пентаналь
CH3 H
Если альдегидная группа в боковой цепи – добавляется окончание КАРБАЛЬДЕГИД, например,
CH3 CH3 CH3
СH3-C - CH-CH - CH-CH3 2,2,4,5-тетраметилгексан-3-карбальдегид
O
CH3 C
H
|
Просмотров 624 |
|
|
