
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Электронное строение нитросоединений
|
|
Нитропарафины имеют следующую октетную формулу:
R:N:O: R-N+  O-
O-
O O
Один атом кислорода образует с азотом двойную связь.
Однако в реальной молекуле связи обоих атомов кислорода с азотом не отличаются друг от друга.
R-N-O-  R-N=O
R-N=O
O O
O-1/2
R-N+
O-1/2
Связи N-O в нитрогруппе обладают высокой полярностью, нитрогруппа имеет отрицательный индукционный эффект.
H H O
H  C
C  C-N+
C-N+
H H O-
В результате поляризующего влияния нитрогруппы сильно увеличивается полярность связей С-Н в  -положении к группе NO2.
-положении к группе NO2.
Физические свойства
Так как нитросоединения содержат очень полярные связи N  O (
O ( 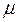 =3,5
=3,5  4,0 Д), они обладают высокой температурой кипения.
4,0 Д), они обладают высокой температурой кипения.
Нитрометан является жидкостью. Ткип=1010С. Далее температура кипения повышается. Нитросоединения обладают высокой плотностью, плотность уменьшается с увеичением радикала. Плотность нитрометана равняется 1,132. В воде растворяются мало, смешиваются со спиртом, эфиром, ядовиты. Полинитросоединения – взрывчатые вещества.
Химические свойства
I. Реакции в нитрогруппе.
Восстановление соединений
CH3NO2 + 6H  CH3NH2 + 2H2O
CH3NH2 + 2H2O
II. Реакции в радикале.
Происходят за счет подвижных атомов водорода в  -положении к нитрогруппе. Такие реакции имеют место только у первичных и вторичных нитросоединений.
-положении к нитрогруппе. Такие реакции имеют место только у первичных и вторичных нитросоединений.
1) Взаимодействие со щелочами. Протекает благодаря способности нитросоединений образовывать таутомерные аци-формы.
H O O O
CH3-C-N  CH3-CH=N
CH3-CH=N  CH3-CH=N + H2O
CH3-CH=N + H2O
H O OH ONa
Нитро-форма аци-форма
Нейтральные соединения, но со щелочами образуют соли с выделением воды. Ганч назвал такие соединения псевдокислотами. К псевдокислотам относятся первичные и вторичные нитросоединения.
CH3 O CH3 O O
CH3-CH-N  CH3-C=N
CH3-C=N 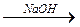 (CH3)2C=N + H2O
(CH3)2C=N + H2O
O OH ONa
2) Действие азотистой кислоты
а) первичные нитросоединения с HNO2 образуют нитроловые кислоты.
O O O O
CH3-CH-N + HO-N=O  CH3-CH-N
CH3-CH-N  CH3-C-N
CH3-C-N 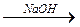 CH3-C-N
CH3-C-N
O N=O O N-OH O N-ONa O
Нитроэтан нитроловая кислота таутомерная форма
нитроловой кислоты
Нитроловая кислота также способна образовывать таутомерные формы, которые обладают кислотными свойствами и реагируют со щелочами с образованием соли, окрашенной в красный цвет. Это качественная реакция на первичные и нитро-соединения.
б) вторичные нитросоединения с HNO2 образуют псевдонитролы.
O N=O O
СH3-CH-N + HO-N=O  H2O + CH3-C - N
H2O + CH3-C - N
CH3 O CH3 O
Псевдонитрол
Раствор псевдонитрола в эфире, а также расплав имеют бирюзовую окраску (качественная реакция вторичных нитросоединений).
3) Конденсация нитросоединений с альдегидами и кетонами
O O OH O O
CH3-C + CH3-CH2-N  CH3-C-CH-N
CH3-C-CH-N  H2O + CH3-CH=C-N
H2O + CH3-CH=C-N
H O H CH3 CH3 O
уксусный нитроэтан 3-нитро-2-бутанол 2-нитро-2-бутен
альдегид
Нитроолефины используются в производстве полименых материалов.
При избытке альдегида могут образовываться многоатомные нитроспирты.
O
HC
H
O H HO-CH2 O2NOCH2
HC + H-C-NO2  HO-CH2-C-NO2 + 3HONO2
HO-CH2-C-NO2 + 3HONO2  O2NOCH2-C-NO2
O2NOCH2-C-NO2
H H HO-CH2 O2NOCH2
O нитрометан триоксиметил тетрит (ВВ)
HC (нитрометан)
H
Формальдегид
4) Действие галогенов
СH3-CH2-NO2 + 2Br2  CH3-CBr2-NO2 + 2HBr
CH3-CBr2-NO2 + 2HBr
нитроэтан 1,1-дибром -1-нитроэтан
3. Отличие химичесикх и физических свойств нитросоединений от свойств изомерных сложных эфиров азотистой кислоты, т.е.
O
R-N R-O-N=O
O
нитропарафинов от алкилнитратов
Физические свойства
1. Эфиры кипят при более низкой температуре
2. Нитропарафины – более полярны
Химические свойства
1.Восстановление. Нитросоединения дают амины. Нитриты восстанавливаются до спирта и гидроксиламина.
CH3-O-N=O + 4H  CH3OH + NH2OH
CH3OH + NH2OH
Метилнитрит
2. Действие водных растворов щелочи. Нитросоединения дают соли ациформ (см. выше). Нитриты – гидролизуются.
CH3-O-N=O + NaOH  CH3OH + NaNO2
CH3OH + NaNO2
|
Просмотров 1121 |
|
|
