
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Химические свойства предельных углеводородов
|
|
Предельные углеводороды имеют в составе молекул только малополярные и слабополяризующиеся  -связи, которые отличаются высокой прочностью, поэтому в обычных условиях они являются веществами мало химически активными по отношению к полярным реагентам: не взаимодействуют с концентрированными кислотами, целочами, щелочными металлами, окислителями. Это и послужило поводом к их названию – парафины.Parumaffinus по латыни малосродственный. Их химические превращения протекают в основном при повышенных температурах и под действием УФ-облучения.
-связи, которые отличаются высокой прочностью, поэтому в обычных условиях они являются веществами мало химически активными по отношению к полярным реагентам: не взаимодействуют с концентрированными кислотами, целочами, щелочными металлами, окислителями. Это и послужило поводом к их названию – парафины.Parumaffinus по латыни малосродственный. Их химические превращения протекают в основном при повышенных температурах и под действием УФ-облучения.
Различают три основных типа реакций предельных углеводородов: замещение, окисление и отщепление. Эти реакции могут идти либо за счет разрыва связи С-С (энергия 83,6 ккал), либо за счет разрыва связи С-Н (энергия 98,8 ккал/моль). Реакции чаще идут с разрывом связи С-Н, т.к. она более доступна действию реагента, хотя связь С-С требует меньше энергии на расщепление. В результате таких реакций промежуточно образуются очень активные частицы – алифатические углеводородные радикалы.
Получение и свойства алифатических радикалов
1. Образование свободных радикалов при гомолитическом расщеплении связей С-С или С-Н происходит при температуре 300-700оС или под действием свободно-радикальных реагентов.
2. Продолжительность существования свободных радикалов (устойчивость) увеличивается от первичных радикалов к вторичным и третичным:
| . СН3 | < | 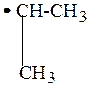
| < | 
|
3. Химические превращения свободных радикалов.
а) Взаимодействие с предельными соединениями – радикал отрывает Н и образуется новый радикал:
| Cl . + | 
|
 HCl + HCl +
| 
|
б) Взаимодействие с непредельными соединениями: происходит присоединение с образованием также нового радикала:
CH3. + CH2=СН2  CH3-CH2-CH2.
CH3-CH2-CH2.
в)  -распад – радикалы с длинной углеродной цепью распадаются с разрывом С-С связи в
-распад – радикалы с длинной углеродной цепью распадаются с разрывом С-С связи в  -положении к углероду с неспаренным электроном.
-положении к углероду с неспаренным электроном.
CH3- CH2 : CH2- CH2 .  CH3-CH2. + CH2=CH2
CH3-CH2. + CH2=CH2
г) Диспропорционирование – перераспределение водорода, связанное с  -распадом по С-Н связи:
-распадом по С-Н связи:

|
+ СН3-СН2. 
| 
| + СН3-СН3 |
д) Рекомбинация – соединение свободных радикалов друг с другом
СН3. + СН3.  СН3-СН3
СН3-СН3
Зная особенности поведения свободных радикалов, легче уяснить основные закономерности конкретных реакций предельных углеводородов.
I тип. Реакция замещения
1.Реакции галоидирования. Самый энергичный реагент – фтор. Прямое фторирование приводит к взрыву. Наибольшее практическое значение имеют реакции хлорирования. Они могут протекать под действием молекул хлора на свету уже при комнатной температуре. Реакция протекает по свободно-радикальному цепному механизму и включает следующие основные стадии:
а) первая медленная стадия – инициирование цепи:
Cl : Cl  Cl. + Cl.
Cl. + Cl.
R : H + . Cl  HCl + R.
HCl + R.
б) развитие цепи – образование продуктов реакции с одновременным образованием свободных радикалов, продолжающих цепной процесс:
R. + Cl : Cl  RCl + Cl.
RCl + Cl.
R : H + Cl.  HCl + R.
HCl + R.
в) обрыв цепи:
R. + Cl.  RCl
RCl
Так как СI. реагент активный, он может атаковать молекулу уже полученного хлорпроизводного, в результате образуется смесь моно- и полигалогенозамещенных. Например:
CH4 + Cl2  HCl + CH3Cl
HCl + CH3Cl  CH2Cl2
CH2Cl2  CHCl3
CHCl3  ССl4
ССl4 
хлористый метил –HCl -HCl -HCl
хлористый метилен хлороформ четырех-
хлористый углерод
Реакция бромирования протекает значительно труднее, т.к. бром менее активен, чем хлор и реагирует в основном с образованием более устойчивых третичных или вторичных радикалов. При этом второй атом брома вступает обычно в соседнее с первым положение, преимущественно у вторичного углерода.

|
+ Br2 
| 
| 
| 
|
| изопентан | бромистый изопентан (2-бром-2-метилбутан) | 2,3-дибром-2-метилбутан |
Реакции иодирования практически не протекают, т.к. HI восстанавливает образующиеся йодистые алкилы.
2.Нитрование – замещение атома Н на группу NО2 при действии азотной кислоты. Идет при действии разбавленной азотной кислоты (12%) при высокой температуре 150оС под давлением (реакция Коновалова). Легче реагируют парафины изостроения, т.к. замещение легче происходит у третичного атома углерода:

|
+ HONO2  H2O + H2O +
| 
|
| изопентан | 2-нитро-2-метилбутан |
Механизм реакции нитрования связан с промежуточным образованием свободных радикалов. Инициированию способствует протекающий частично процесс окисления:
RH + HONO2  ROH + HONO
ROH + HONO
азотистая кислота
HONO + HONO2  HOH + 2 . NO2
HOH + 2 . NO2

|
+ . NO2 
|
H .
CH3-C-CH3 + . NO2  CH3-C-CH3 + HNO2
CH3-C-CH3 + HNO2
CH3 CH3
. NO2
CH3-C-CH3 + . NO2  CH3-C-CH3
CH3-C-CH3
CH3 CH3
т.е. радикальная реакция нитрования углеводородов не имеет цепного характера.
II тип. Реакции окисления
При обычных условиях парафины не окисляются ни кислородом, ни сильными окислителями (KMnO4, HNO3, K2Cr2O7 и др.).
При внесении открытого пламени в смесь углеводорода с воздухом происходит полное окисление (сгорание) углеводорода до СО2 и Н2О. Нагревание предельных углеводородов в смеси с воздухом или кислородом в присутствии катализаторов окисления MnО2 и других до температуры 300оС приводит к их окислению с образованием перекисных соединений. Реакция протекает по цепному свободно-радикальному механизму.
И: R : H  R. + H. инициирование цепи
R. + H. инициирование цепи
.. ..
Р: R. + O: :O:  R-O-O.
R-O-O.
.. ..
R-O-O. + R : H  R-O-O-H + R.
R-O-O-H + R.
гидроперекись алкана
O: R-O-O. + R.  R-O-O-R обрыв цепи
R-O-O-R обрыв цепи
перекись алкана
Легче всего подвергаются окислению третичные звенья, труднее вторичные и еще труднее – первичные. Образующиеся гидроперекиси разлагаются.
Первичные гидроперекиси при разложении образуют альдегиды или первичный спирт, например:
Н Н
СН3-С-С-О : О-Н  CН3-С-О . + . ОН
CН3-С-О . + . ОН  СН3-С=О + Н2О
СН3-С=О + Н2О
Н Н Н
гидроперекись этана уксусный альдегид
+ СН3-СН3
побочная
СН3-СН2ОН + СН3-СН2 .
Вторичные гидроперекиси образуют при разложении кетоны или вторичные спирты, например:
Н Н
СН3-С-О:ОН  СН3-С-О . + . ОН
СН3-С-О . + . ОН  Н2О + СН3-С=О
Н2О + СН3-С=О
СН3 СН3 СН3
гидроперекись пропана
+ СН3-СН2-СН3
побочная
СН3-СН-ОН + СН3-. СН-СН3
СН3
изопропиловый спирт
Третичные гидроперекиси образуют кетоны, а также первичные и третичные спирты, например:
СН3 СН3 СН3
СН3-С-СН3  СН3-С : СН3 + . ОН
СН3-С : СН3 + . ОН  СН3ОН + СН3-С=О
СН3ОН + СН3-С=О
О-ОН О
гидроперекись изобутана
+ СН3-СН-СН3
СН3
Побочная
Изобутан
СН3 .
СН3-С-СН3 + СН3-С-СН3
ОН СН3
третбутиловый спирт
Любая гидроперекись может разлагаться также с выделением атомарного кислорода: СН3-СН2-О-О-Н  СН3СН2-ОН + [O],
СН3СН2-ОН + [O],
который идет на дальнейшее окисление:
О О
СН3-С + [О]  СН3-С-ОН
СН3-С-ОН
Н
Поэтому кроме спиртов, альдегидов и кетонов образуются карбоновые кислоты.
Подбором условий реакции можно добиться получения одного какого-либо продукта. Например: 2 СН4 + О2  2 СН3ОН.
2 СН3ОН.
В промышленных масштабах окислением предельных углеводородов (С10-С20) получают синтетические жирные кислоты (СЖК).
По мере увеличения углеводородной цепочки способность углеводорода к окислению увеличивается. Например, эйкозан окисляется при 100оС.
Н
С17Н35-СН2-СН2-СН3 + О2  С17Н35-СН2-С-СН3
С17Н35-СН2-С-СН3 
эйкозан О-ОН
гидроперекись эйкозана
О О
 Н2О + С17Н35-СН2 + С-СН3
Н2О + С17Н35-СН2 + С-СН3  С17Н35-С-ОН + СН3-С-ОН
С17Н35-С-ОН + СН3-С-ОН
О
метилоктадецилкетон стеариновая кислота
2-нонадеканон (октадекановая)
Используется для производства мыла, ее натриевой соли, стеарата натрия.
III тип. Реакции термического расщепления
предельных углеводородов
1.Крекинг – расщепление предельных углеводородов на более низкомолекулярные предельные и непредельные углеводороды. Протекает при нагревании без доступа воздуха до 450-550оС. Механизм термического крекинга – свободно-радикальный.

 2 1 1 СН3-СН2-СН2 . . СН3
2 1 1 СН3-СН2-СН2 . . СН3  СН3-СН=СН2+СН4
СН3-СН=СН2+СН4
 СН3-СН2 : СН2 : СН3
СН3-СН2 : СН2 : СН3
 бутан 2 СН3-СН2 . + . СН2-СН3
бутан 2 СН3-СН2 . + . СН2-СН3  СН2=СН2+СН3-СН3
СН2=СН2+СН3-СН3
При расщеплении более высокомолекулярных углеводородов при невысоком давлении могут протекать реакции  -распада образовавшихся свободных радикалов.
-распада образовавшихся свободных радикалов.
С10Н22  2СН3-СН2-СН2 : СН2-СН2
2СН3-СН2-СН2 : СН2-СН2  2СН3-СН2-СН2 . + 2СН2=СН2
2СН3-СН2-СН2 . + 2СН2=СН2
Декан 2С10Н22
2С10Н21 . + 2СН3-СН2-СН3
2.Дегидрирование (дегидрогенизация) – отщепление водорода происходит под действием более высокой температуры, чем крекинг.

 СН3-СН=СН-СН3 2-бутен
СН3-СН=СН-СН3 2-бутен
СН3-СН2-СН2-СН3 
бутан -Н2
 СН3-СН2-СН=СН2 1-бутен
СН3-СН2-СН=СН2 1-бутен
В присутствии катализаторов, например, Сr2O3, температура реакции может быть снижена до 300оС.
|
Просмотров 1494 |
|
|
