
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Общие математические и естественнонаучные дисциплины 5 часть
|
|
Рецензент: к.ф.-м.н., проф. кафедры «Прикладная Физика», П.П. Рымкевич.
ХИМИЯ
ЦЕЛИ И ЗАДАЧИ ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
Основные цели дисциплины - подготовка специалистов, обладающих фундаментальными знаниями и практическими навыками решения задач в области химии.
Задачи дисциплины - научить студентов:
– основным законам химии;
– общим закономерностям протекания химических превращений.
Знания, полученные при изучении дисциплины, позволяют сформулировать наиболее оптимальный комплекс знаний будущего специалиста в основных направлениях его профессиональной деятельности по обслуживанию, контролю и управлению технологических процессов.
ТРЕБОВАНИЯ К УРОВНЮ ОСВОЕНИЯ СОДЕРЖАНИЯ ДИСЦИПЛИНЫ
В результате изучения дисциплины «Химия » студент должен:
· знать:
– состав, строение и свойства атомов химических элементов;
– основные классы органических и неорганических соединений;
– общие закономерности протекания химических процессов;
– методы проведения химического и физико-химического анализа индивидуальных веществ и смесей.
· уметь:
– осуществлять цепь химических превращений веществ;
– анализировать качественный и количественный состав веществ;
– готовить растворы веществ определенной концентрации.
· получить навыки:
– работы на современных химических приборах и оборудовании;
– планирования постановки исследовательской работы в области прикладной химии.
ВИДЫ УЧЕБНОЙ РАБОТЫ. УЧЕБНО-ТЕМАТИЧЕСКАЯ КАРТА ДИСЦИПЛИНЫ
| № п/п | Наименование темы | Объем аудиторных занятий (в часах) | Объем сам. раб. студентов (в час.) | ||||
| лекции | лаб. раб. | пр. зан. | сем. зан. | итого | |||
| Раздел 1: Общая химия | |||||||
| 1. | Введение | - | - | - | |||
| Состав, строение и свойства атомов химических элементов | - | - | - | ||||
| 2. | Химическая связь и реакционная способность веществ | - | |||||
| 3. | Элементы химической термодинамики | - | - | ||||
| 4. | Химия веществ в конденсированном состоянии | - | - | ||||
| 5. | Гомогенные химические системы и процессы | - | |||||
| 6. | Электрохимические системы | - | - | ||||
| Раздел 2: Общая характеристика химических элементов и их соединений | |||||||
| 7. | Свойства химических элементов и простых веществ. | - | - | ||||
| 8. | Классы органических и неорганических соединений | - | - | ||||
| 9. | Общие свойства металлов | - | |||||
| 10. | Химия воды | - | |||||
| 11. | Органические полимерные материалы | - | - | ||||
| Раздел 3: Химическая идентификация | |||||||
| 12. | Теоретические основы реакций, применяемых в аналитической химии | - | - | ||||
| 13. | Качественный анализ. Аналитический сигнал. | - | - | ||||
| 14. | Количественный анализ | - | |||||
| 15. | Физико-химический и физический анализ | - | - | ||||
| Всего: | - | ||||||
| Формы итогового контроля: | Курс. работа (проект) | Контр. работа | Зачет | Экзамен | |||
| Семестры: | - | - | - | ||||
| Для заочной формы обучения | |||||||
| Всего: | - | - | |||||
| Формы итогового контроля: | Курс. работа (проект) | Контр. работа | Зачет | Экзамен | |||
| Семестры: | - | - |
СОДЕРЖАНИЕ ДИСЦИПЛИНЫ
ТЕОРЕТИЧЕСКИЕ ЗАНЯТИЯ
Раздел 1: Общая химия
Введение
Современный уровень и основные тенденции в развитии химии. Химия в сфере быта и услуг. Химия и экология. Основные понятия химии.
Тема 1. Состав, строение и свойства атомов химических элементов
Состав, строение и свойства атомов химических элементов.Периодический закон Д.И. Менделеева.
Тема 2. Химическая связь и реакционная способность веществ
Химическая связь. Методы валентных связей и молекулярных орбиталей. Водородная связь. Химическая связь в комплексных соединениях.Колебательные реакции.
Практическое занятие: Строение атома и систематика элементов.
Изучение электронной структуры атомов и периодической системы элементов.
Лабораторное занятие: Техника лабораторных работ.
Ознакомление с организацией лаборатории, правилами работы и техникой безопасности, оборудованием и приборами.
Тема 3. Элементы химической термодинамики
Элементы химической термодинамики.Закон Гесса. Понятие о химической кинетике, основы катализа. Химическое равновесие, принцип Ле-Шателье.
Лабораторное занятие: Химическое равновесие.
Исследование влияния концентрации реагирующих веществ, температуры, давления в системе на состояние химического равновесия.
Тема 4. Химия веществ в конденсированном состоянии
Агрегатное состояние веществ. Межмолекулярное взаимодействие в жидкостях. Аморфное и кристаллическое состояние твердых веществ. Идеальные и реальные кристаллические решетки. Химическая связь в твердых телах: металлах, полупроводниках, диэлектриках.
Практическое занятие 1: Химическая связь
Изучение основных видов химической связи, понятия валентности и степени окисления в свете теории строения вещества.
Практическое занятие 2:
Изучение свойств растворов неэлектролитов.
Тема 5. Гомогенныехимические системы и процессы
Типы растворов. Растворение и растворимость. Способы выражения концентрации растворов. Растворы неэлектролитов и их свойства. Теория электролитической диссоциации Аррениуса. Растворы электролитов и их свойства. Закон разбавления Оствальда. Произведение растворимости. Электролитическая диссоциация воды. Протолитическое равновесие. Водородный показательсреды.Гидролиз солей.
Лабораторное занятие 1:
Приготовление растворов определенной концентрации.
Лабораторное занятие 2:
Определение рН водных растворов кислот, солей, оснований.
Тема 6. Электрохимические системы
Кислотно-основные и окислительно-восстановительные свойства веществ. Электрохимические процессы. Стандартные электродные потенциалы металлов. Химические источники тока: гальванические элементы, аккумуляторы, топливные элементы. Электролиз в растворах и расплавах. Коррозия металлов. Защита металлов от коррозии.
Практическое занятие:
Водные растворы электролитов. Ионные реакции в растворах. Водный показатель. Гидролиз. Составление уравнений окислительно-восстановительных реакций.
Раздел 2: Общая характеристика химических элементов и их соединений
Тема 7. Свойства химических элементов и простых веществ
Аллотропия. Полиморфизм. Классификация простых веществ. Нахождение элементов в природе. Получение, свойства простых веществ. Общая характеристика свойств s-элементов и простых веществ 1 и 2 групп периодической системы элементов. Общая характеристика p-элементов и простых веществ 3-7 групп периодической системы. Общая характеристика d-элементов и простых веществ.
Лабораторное занятие: Углерод и кремний. Соединения углерода и кремния
Изучение основных свойств углерода, кремния и их соединений.
Тема 8. Классы органических и неорганических соединений
Классификация неорганических соединений, способы их получения и взаимосвязь между ними. Химия комплексных соединений. Комплексы, комплексообразователи, лиганды, заряд и координационное число комплексов. Комплиментарность.
Практическое занятие:
Изучение свойств оксидов, оснований, кислот, солей.
Тема 9. Общие свойства металлов
Основные химические свойства металлов-материалов, применяемых при изготовлении и эксплуатации изделий сервиса. Характерные физические свойства металлов. Природные химические соединения.Основные способы добывания металлов из руд. Металлы, сплавы и интерметаллические соединения в технике, в сфере сервиса.
Лабораторное занятие 1: Ряд напряжения металлов. Гальванический элемент.
Изучение строения и работы гальванических элементов.
Лабораторное занятие 2: Коррозия металлов.
Изучение основных видов и схем коррозионного процесса, методов защиты материалов от коррозии.
Тема 10. Химия воды
Химические и физические свойства воды. Природные воды и их состав. Основы водоподготовки: устранение жесткости, очистка методами осаждения, ионного обмена, мембранными методами.
Лабораторное занятие:
Анализ свойства соединений магния и кальция. Жесткость воды
Практическое занятие:
Изучениехимических и физических свойств воды.
Тема 11. Органические полимерные материалы
Химия полимеров и полимерных конструкционных материалов. Каучуки и резины. Полимерные покрытия, клеи, герметики. Использование химических соединений в технологиях сервиса.
Лабораторное занятие:
Определение температуры плавления органического вещества
Раздел 3: Химическая идентификация
Тема 12. Теоретические основы реакций, применяемых в аналитической химии
Теоретические основы кислотно-основного взаимодействия. Буферные растворы. Теоретические основы гидролиза.
Практическое занятие:
Изучение буферных систем и их применение в химическом анализе.
Тема 13.Качественный анализ. Аналитический сигнал
Аналитическая классификация катионов. Основные методы обнаружения катионов I,II, III, IV и V аналитических групп. Аналитическая классификация анионов. Основные методы обнаружения анионов I и II аналитических групп.
Практическое занятие:
Качественное определение катионов и анионов.
Тема 14. Количественный анализ
Предмет и методы количественного анализа. Гравиметрический, титриметрический анализ. Метод окисления – восстановления, электрохимический и фотометрический метод анализа.
Лабораторное занятие:
Определение содержания железа в растворе хлорида железа весовым методом. Определение содержания аммиака в солях аммония методом обратного титрования. Ознакомление с принципами работы фотоколориметра.
Тема 15. Физико-химический и физический анализ
Хроматографический метод анализа. Спектральный анализ. Люминесцентный анализ. Радиометрический анализ. Кондуктометрия. Потенциометрия. Химический практикум.
Практическое занятие:
Построение калибровочных кривых.
ОРГАНИЗАЦИЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТА
Самостоятельная работа студентов включает в себя:
– самостоятельное изучение теоретических разделов дисциплины по заданию лектора (химия и экология, использование химических соединений в технологиях сервиса, металлы, сплавы и интерметаллические соединения в технике, в сфере сервиса);
– повторение и углубленное изучение лекционного материала;
– решение практических задач и подготовку к практическим занятиям;
– выполнение лабораторных работ;
– подготовку к экзамену.
ТЕМАТИКА КОНТРОЛЬНЫХ РАБОТ
(для заочной формы обучения)
1. Строение атома, химическая связь, строение вещества.
2. Химическая термодинамика, химическая кинетика и равновесие.
3. Растворы, свойства растворов.
4. Основы электрохимии.
5. Неорганическая химия.
6. Органические соединения, полимеры
ФОРМЫ И ВИДЫ КОНТРОЛЯ ЗНАНИЙ
1. Текущий контроль:
─ опрос на практических занятиях;
─ выполнение контрольных заданий и задач;
─ отчет по результатам выполнения лабораторных работ;
─ защита контрольной работы;
─ рубежный контроль.
2. Промежуточная аттестация – зачетно-экзаменационная сессия:
─ экзамен проводится в устной или письменной форме при условии выполнения всех форм текущего контроля и в соответствии с учебным планом.
3. Контроль остаточных знаний студентов (тесты).
ПЕРЕЧЕНЬ ВОПРОСОВ ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ
1. Квантово - механическая модель атома. Квантовые числа.
2. Квантово - механическая модель атома.
3. Принцип запрета Паули. Правила Гунда.
4. Правила Клечковского.
5. Строение атома и химические свойства элементов.
6. Периодический закон и периодические свойства элементов.
7. Типы химической связи. Ковалентная связь.
8. 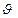 и π - связь. Ионная связь.
и π - связь. Ионная связь.
9. Типы химической связи. Донорно-акцепторная связь.
10. Типы химической связи. Водородная связь.
11. Типы химической связи. Металлическая связь.
12. Типы химической связи. 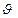 и π - связь.
и π - связь.
13. Гибридизация атомных орбиталей.
14. Метод валентных связей.
15. Метод молекулярных орбиталей.
16. Полярные и неполярные молекулы.
17. Межмолекулярное взаимодействие и физические свойства.
18. Типы кристаллических решеток и физико-химические свойства твердых тел.
19. Химическая связь в твердых телах.
20. Растворы. Растворимость.
21. Диссоциация слабых электролитов. Константы диссоциации.
22. Растворы. Общие свойства растворов.
23. Растворы. Способы выражения концентрации растворов.
24. Растворы неэлектролитов. Давление пара раствора.
25. Растворы неэлектролитов. Повышение и понижение температуры кипения и замерзания растворов.
26. Растворы электролитов, их свойства. Ионные реакции.
27. Произведение растворимости.
28. Электролитическая диссоциация воды. Водородный показатель.
29. Гидролиз солей.
30. Скорость химической реакции и факторы, влияющие на нее.
31. Скорость химической реакции. Влияние концентрации веществ.
32. Скорость химической реакции. Влияние температуры.
33. Скорость химической реакции. Влияние катализатора.
34. Химическое равновесие. Смещение равновесия. Принцип Ле-Шателье.
35. Химическое равновесие. Влияние концентрации.
36. Химическое равновесие. Влияние температуры.
37. Химическое равновесие. Влияние давления.
38. Гетерогенные дисперсные системы.
39. Тепловые эффекты химических реакций. Термохимические законы.
40. Энтальпия. Энтропия.
41. Энергия Гиббса. Условия самопроизвольного протекания химических реакций.
42. Валентность. Степень окисления.
43. Окислительно-восстановительные свойства веществ.
44. Электродные потенциалы металлов.
45. Стандартный водородный электрод и водородная шкала потенциалов уравнения неравенства.
46. Гальванические элементы - химические источники тока.
47. Концентрированные химические источники тока.
48. Химические источники тока. Аккумуляторы.
49. Химические источники тока. Топливный элемент.
50. Электролиз в растворах.
51. Электролиз в расплавах.
52. Законы электролиза.
53. Коррозия металлов.
54. Методы защиты металлов от коррозии.
55. Общая характеристика металлов: физические и химические свойства.
56. Общая характеристика металлов подгруппы железа периодической системы.
57. Основные свойства олигомеров и полимеров. Полимеризация.
58. Полимеры и пластмассы.
59. Поликонденсационные полимеры – синтетические волокна нейлон и капрон.
60. Химический, физико-химический анализ индивидуальных веществ и смесей.
УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная:
1. Глинка, Н. Л. Общая химия : учеб. пособие / Н. Л. Глинка ; под ред. А. И. Ермакова. - М. : Интеграл-Пресс, 2005.
2. Глинка, Н. Л. Задачи и упражнения по общей химии : учеб. пособие / Н. Л. Глинка ; под ред. В. А. Рабиновича. - М. : Интеграл-Пресс, 2003.
3. Коржуков, Н. Г. Общая и неорганическая химия : учеб. пособие / Н. Г. Коржуков. - М. : ИНФА-М : МИСИС, 2004.
4. Практикум по неорганической химии : учеб. пособие / В. А. Алешин, К. М. Дунаева, А. И. Жиров ; под ред. Ю. Д. Третьякова. - М. : Академия, 2006.
Дополнительная:
1. Бронников, С. В. Химия. Решения типовых задач : метод. указ. по изучению курса / С. В. Бронников, Н. А. Смолина. - СПб. : СПбГИСЭ, 2000.
2. Гаршин, А. П. Неорганическая химия в схемах, рисунках, таблицах, химических реакциях : учеб. пособие / А. П. Гаршин. – СПб. : Лань, 2003.
3. Гаршин, А. П. Органическая химия в рисунках, таблицах, схемах : учеб. пособие /А. П. Гаршин. – СПб. : ХИМИЗДАТ, 2006.
4. Карапетьянц, М. Х. Общая и неорганическая химия : учебник / М. Х. Карапетьянц, С. М. Дракин. - М. : Химия, 1994.
5. Коровин, Н. В. Общая химия : учебник / Н. В. Коровин. - М. : Высшая школа, 2002.
6. Общая и неорганическая химия : учеб. пособие / В. В. Барагузина, Е. В. Федоренко, И. В. Богомолова. - М. : ПРИОР, 2006.
7. Шиманович, И. Л. Химия : метод. указ., программы, типовые задачи, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) вузов : учеб. пособие / И. Л. Шиманович. - М. : Высшая школа, 2001.
Периодические издания:
1. Журнал Всероссийского химического общества имени Д. И. Менделеева.
2. Журнал общей химии.
3. Журнал прикладной химии.
МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
Лабораторные работы проводятся в специализированном лабораторном классе «Химии», оснащенным следующим оборудованием:
– весами аналитическими и квадрантными «ВЛК-500»;
– вытяжными шкафами;
– холодильником;
– песчаными и водяными банями;
– электрическими плитками;
– химической посудой;
– химическими реактивами.
Составитель: д.х.н., проф. кафедры «Экспертизы товаров и технологии общественного питания» Я.В. Зачиняев.
Рецензент: к.х.н., доц. кафедры «Экспертизы товаров и технологии общественного питания» О.А. Черемисина.
ЭКОЛОГИЯ
ЦЕЛИ И ЗАДАЧИ ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
Основная цель дисциплины – формирование у студентов биоцентрического мировоззрения и способностей оценивать профессиональную деятельность с позиций рационального использования природных ресурсов и охраны окружающей среды, что дает представление о взаимоответственности экономики и экологии как основы устойчивого развития общества.
Задачи дисциплины – научить студентов:
- новому пониманию и осознанию роли человеческого сообщества, необходимости нового экологического поведения;
- особенностям экологического мышления;
- рассматривать любую деятельность с позиций включения хозяйства в биосферные циклы;
- принимать экологические факторы как обязательно присущие параметры любой экономической или технической системы;
- некоторым специфическим методикам расчета (определение экономического ущерба и т.д.).
Комплекс знаний должен помочь будущим специалистам организовать человеческую деятельность в условиях жесткого экологического императива.
ТРЕБОВАНИЯ К УРОВНЮ ОСВОЕНИЯ СОДЕРЖАНИЯ ДИСЦИПЛИНЫ
В результате изучения дисциплины «Экология» студент должен:
· знать:
- общеметодологический инструментарий, причины, логику возникновения и развития экологической науки, выделяя ее особенности, раскрывая представление о структуре экосистем и биосферы;
- основные категории и законы экологии;
- особенности взаимоотношения организма и среды, значение экологических факторов для сохранения здоровья человека;
- причины возникновения глобальных экологических проблем;
- экологические принципы использования природных ресурсов и охраны природы;
- элементы экозащитной техники и технологий;
- основы экологического права и профессиональной ответственности;
· уметь:
- ориентироваться в многообразии научных направлений, школ, концепций экологии;
- использовать фундаментальные понятия, основные законы, правила, принципы, модели классической и современной экологической науки, а также методы теоретического и экспериментального исследования;
- прогнозировать последствия своей профессиональной деятельности с точки зрения биосферных процессов;
- выявлять приоритеты в реализации мероприятий, направленных на минимизацию экологического риска;
- проводить расчеты основных параметров загрязнения окружающей среды;
- определять экономический ущерб от загрязнения окружающей среды;
- анализировать взаимосвязи экологических проблем на локальном и глобальном уровнях.
ВИДЫ УЧЕБНОЙ РАБОТЫ. УЧЕБНО-ТЕМАТИЧЕСКАЯ КАРТА ДИСЦИПЛИНЫ
| № п/п | Наименование темы | Объем аудиторных занятий (в часах) | Объем сам. раб. студентов (в час.) | ||||
| лекции | лаб. раб. | пр. зан. | сем. зан. | итого | |||
| Введение | - | - | - | - | |||
| Раздел 1: Основы общей (классической) экологии | |||||||
| 1. | Организм и факторы среды | - | - | ||||
| 2. | Популяция как элемент экосистемы | - | - | - | |||
| 3. | Биоценоз как биологическая система | - | - | - | |||
| 4. | Концепция экосистемы | - | - | - | |||
| 5. | Основные положения учения о биосфере и ее строении | - | - | ||||
| Раздел 2: Экология человека | |||||||
| 6. | Биосфера и человек | - | - | - | |||
| Раздел 3: Глобальная экология | |||||||
| 7. | Глобальные проблемы окружающей среды | - | - | ||||
| Раздел 4: Прикладная экология | |||||||
| 8. | Теоретические и правовые основы рационального природопользования | - | - | ||||
| 9. | Стратегия и практика рационального природопользования | - | - | ||||
| 10. | Инженерная защита окружающей среды | - | |||||
| 11. | Проблемы современного экологического менеджмента | - | - | ||||
| Раздел 5: Экологизация общества как инструмент мировой экополитики | |||||||
| 12. | Концепция устойчивого развития биосферы | - | - | ||||
| Всего: | - | ||||||
| Формы итогового контроля: | Курс. работа (проект) | Контр. работа | Зачет | Экзамен | |||
| Семестры: | - | - | - | ||||
| Для заочной формы обучения | |||||||
| Всего: | - | - | |||||
| Формы итогового контроля: | Курс. работа (проект) | Контр. работа | Зачет | Экзамен | |||
| Семестры: | - | - |
СОДЕРЖАНИЕ ДИСЦИПЛИНЫ
ТЕОРЕТИЧЕСКИЕ ЗАНЯТИЯ
Раздел 1: Основы общей (классической) экологии
Введение
Экология – задачи и перспективы. Экология как наука. История развития науки. Значение работ К. Рулье, Ч. Дарвина и Э. Геккеля в истории экологической науки. Введение термина «Экология» Эрнстом Геккелем для обозначения науки о взаимоотношениях организмов между собой и с окружающей средой. Место экологии в системе научных знаний. Разделы и тематика экологии. Аутоэкология, демэкология, синэкология. Современные представления о фундаментальной экологии и ее структуре. Проблемы, изучаемые экологией. Экологизация общественных и естественных наук. Экосистемный подход в экологии. Методы экологических исследований. Особенности применения математического моделирования. Экологическое прогнозирование. Исторический аспект формирования отношения человека к природе. Формирование облика биосферы в процессе жизнедеятельности организмов. Проблема оптимизации взаимодействия общества и природы. Экологические знания как основа взаимодействия человека с окружающей средой, рационального использования природных ресурсов. Экологическая наука – решающая сила века.
Тема 1.Организм и факторы среды
Взаимоотношения организма и среды. Фундаментальные свойства живых систем. Закон физико-химического единства живого вещества В.И. Вернадского. Уровни биологической организации. Организм как дискретная самовоспроизводящаяся открытая система, связанная со средой обменом вещества, энергии и информации. Закон хиральной чистоты живого. Закон максимума биогенной энергии В.И. Вернадского – Э.С. Брауэра. Автотрофы и гетеротрофы. Фотосинтез - процесс планетарного масштаба. Основные группы фотосинтезирующих организмов. Хемосинтез. Основные группы гетеротрофов. Трофические отношения между организмами. Понятие экологического фактора и принцип действия. Экологическая толерантность. Купол толерантности. Закон Ю. Либиха – один из основополагающих законов экологии. Закон толерантности В. Шелфорда. Адаптация как биологическое явление. Гомеостаз; принципы регуляции жизненных функций. Общий закон биологической стойкости (по М. Ламотту). Типы и уровни адаптации, ее генетические пределы. Правило Аллена. Эврибионтность и стенобионтность. Правило Бергмана. Гомойо и пойкилотермность. Правило Вант-Гоффа. Совместное действие нескольких факторов. Правило Глогера. Введение термина «экотип» шведским ботаником Г. Турессоном. Традиционные классификации экологических факторов. Закон В.Р. Вильямса. Жизненные формы растений (по Раункиеру) и жизненные формы животных. Принципы воспроизведения и развития различных организмов. Закон биогенетический Ф. Мюллера - Э. Геккеля. Особенности зависимости организма от среды на разных стадиях жизненного цикла. Живые организмы – индикаторы среды как комплекса экологических факторов. Биотестирование и биоиндикация как методы контроля качества среды.
|
Просмотров 556 |
|
|
