
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Возбуждения ЭТИХ КЛеТОК, Vm.nx П 1 часть
|
|
амплитуды их ПД [Noble D., 1985]. Клиницистам хорошо известно, как чувствителен синусовый ритм к бло-каторам Са каналов (L-типа) кле-
точной мембраны (верапамил) либо к р-адреноблокаторам (пропранолол), тоже влияющим на эти каналы через катехоламины. При анализе Са механизмов нельзя не учитывать активности Na+-Ka+-MeM6pairaoro насоса, Na+-Ca++-o6MeHnoro механизма, а также роли внутриклеточных систем, обеспечивающих секвестрацию и выделение ионов Са++. Накопление знаний в этой области биофизики происходит интенсивно, что позволит в ближайшем будущем еще больше приблизиться к истине [Noble D., 1985; Hagiwara N. et al., 1988; Levy M., 1990].
С электрофизиологических позиций, интервал меясду сокращениями сердца равен отрезку времени, п течение которого мембранный потепцп-ал покоя в клетках СА узла смещается до уровня порогового потенциала возбуждения. Три механизма оказывают влияние на продолжительность этого интервала и, следовательно, на частоту сердечной деятельности.
Первый из них (наиболее важный) — скорость (крутизна) диастолической деполяризации. При ее возрастании пороговый потенциал возбуждения достигается быстрее п происходит учащение синусового ритма (рис. 5). Противоположный эффект, т. е. замедление спонтанной диастолической деполяризации, ведет к урежению синусового ритма (рис. 6). Следует еще раз подчеркнуть, что С А узел не должен рассматриваться как однородный водитель ритма: в нем имеются группы клеток с различным уровнем автоматизма, и соответственно локализация пейсмекера в пределах СА узла может изменяться.
Второй механизм, оказывающий влияние тта уровень автоматизма СА узла, — изменение мембранного потенциала покоя его клеток (максимального диастолического потенциала). При увеличении этого потенциала (в абсолютных значениях), т. е. при гиперполяризации клеточной мембраны (например, под воздей-

|
| ~10QL |
Рис. 5. Ускорение спонтанной диастолической деполяризации в клетках Пуркинье под воздействием адреналина (no M. Otsuka),
I — до адреналина; П — через 10 мин после добанления адреналина.

|
Рис. 6. Влияние ацетилхолина на скорость спонтанной диастолической деполяризации в СА узле сердца кролика — замедление деполяризации с образованием длинных пауз (но М. Otsuka).
ствием ацетилхолина), требуется больше времени для достижения порогового потенциала возбуждения, если, разумеется, скорость диастолической деполяризации остается неизменной. Следствием такого сдвига будет уменьшение числа сердечных сокращений в единицу времени.
Третий механизм — изменение порогового потенциала возбуждения. Его смещение по направлению к нулю удлиняет путь диастолической деполяризации и способствует урежению синусового ритма. Приближение порогового потенциала к потенциалу покоя сопровождается учащением синусового ритма. Возможны и различные комбинации трех основных :>лектрофизиологиче-ских механизмов, регулирующих ав-
томатизм СА узла. Соотношение между ними показано на рис. 7, 8.
Преобладание СА узла над остальными водителями ритма, рассеянными в проводящей системе сердца, обеспечивается прежде всего присущим ему более высоким уровнем автоматизма (скоростью спонтанной диастолической деполяризации), что приводит к опережающей разрядке латентных автоматических центров синусовыми импульсами. В этом проявляется «иерархия» автоматизма. Другой фактор, способствующий ведущей роли СА узла, — сверхчастое подавление (overdrive suppression — OS) скрытых пейсмекеров, т. е. временное подавление или угнетение их спонтанной активности после частой разрядки. В основе этого явления лр-

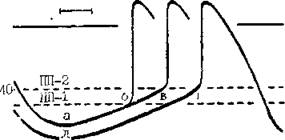
Рис. 7. Механизмы, изменяющие частоту синусового ритма.
Замедление синусового ритма при уменьшении скорости (крутизны) диастолической деполяризации (от а к б).
|
| -20- |
| -GO- |
100 мс
-80-
Рис. 8. Механизмы, изменяющие частоту синусового ритма. Замедление синусового ритма при смещении порогового потенциала (ПП) от ПП-1 до ПП-2 (от б к в); замедление синусового ритма при увеличении максимального диастолического потенциала от а до д (по В. Hoffman, P. Cranefield).
жат уменьшение скорости спонтанной диастолической деполяризации, гиперполяризация автоматических меток и смещение их порогового потенциала возбуждения к менее отрицательным величинам за счет того, что эти клетки подвергаются активации, более частой, чем их собственная частота возбуждения. М. Vassalle (1977, 1985) показал, что торможение автоматизма при OS связано с тем, что Na+-K+-Hacocy мембраны требуется сравнительно много времени для удаления накопившихся в клетках ионов Na+. Еще один механизм, ограничивающий функцию скрытых водителей ритма, — электротоническое взаимодействие между сократительными и автоматическими клетками. В гл. 1 были представлены соображения A. Wit и
P. Cranefield (1982) об электротоническом угнетении автоматизма клеток АВ узла предсердными клетками.
Изменения нормального автоматизма в СА узле или в скрытых автоматических центрах являются причиной возникновения таких аритмий, как: синусовые тахикардия, бради-кардия, аритмия, медленные (замещающие) и ускоренные выскальзывающие комплексы и ритмы (пред-сердные, атриовентрикулярные и идиовентрикулярные), миграция наджелудочкового водителя ритма, А В диссоциация.
АНОРМАЛЬНЫЙ АВТОМАТИЗМ
Впервые этот вид автоматической активности был обнаружен S. Imani-shi (1971) на препаратах волокон Пуркинье. Напомним, что физиологическая спонтанная диастолическая деполяризация в волокнах Пуркинт.р начинается от высокого уровня максимального диастолического потенциала (80—90 мВ) ("high potential automacity"). Она обеспечивает выработку за 1 мин ^30—40 импульсов (при физиологической концентрации ионов К+) и возрастание импуль-сации до 100 в 1 мин под воздействием адреналина. Другая форма спонтанной диастолической деполяризации, названная анормальным автоматизмом, начинается в тех же клетках при их частичной деполяризации, т. е. снижении их максимального диастолического потенциала до 60— 40 мВ ("low potential automacity") [Cranefield P., 1975].
Такого рода явление можно наблюдать в препарате волокон Пуркинье собаки, обработанном бария хлоридом, а также в сохранивших жизнеспособность субэндокардиаль-ных волокнах Пуркинье сердца животного через 24 ч после перевязки венечной артерии и развития острого инфаркта миокарда [Сосунов Е. А. и др., 1990; Dangman К., Hoffman В., 1980, 1985]. Спонтанно возникающим
ПД присущ медленный электрический ответ, что связано с низким уровнем мембранного потенциала покоя поврежденных клеток Пуркинье. Частота же их автоматического ритма лыше физиологической, т. е. свойственной этим клеткам [Gilmonr R., 7л-pes D., 198-1].
Ряду авторов удавалось вызвать анормальную автоматическую активность в частично деполяризованных сократительных клетках предсердий и желудочков [Surawitz В., Imani-shi S., 1976; Katzung B. et al., 1977, 1985]. D. Singer и соавт. (1981) находили аналогичную по характеру активность в ткани предсердий, резецированной у больных, страдавших приступами очаговой (фокусной) ггредсердной тахикардии.
Рассматривая механизмы анормального автоматизма, В. Katzung и соавт. (1985), указывают на то, что его главным компонентом является зависящий от времени выходящий К+ ток ik. Однако имеются данные об участии в этом процессе и входящих в клетку Na+ и Са++ токов. В частности, R. Gilmour и D. Zipes (1984) подчеркивают сходство между ПД, генерируемыми частично деполяризованной клеточной мембраной, и ПД автоматических клеток СА п АВ узлов. Амплитуда тех и других, а также скорость диастолической деполяризации возрастают под влиянием катехоламинов и повышенной концентрации ионои Са++ в среде. Вера-памил, дилтиазем и резкое снижение внеклеточной концентрации ионов Са++ могут полностью подавить анормальную автоматическую активность.
В отличие от физиологического автоматизма, анормальный автоматизм в гипополяризованных волокнах Пуркинье устойчив к сверхчастому подавлению, т. е. после его окончания патологические а втоматические импульсы появляются с прежней или даже с большей частотой. Возможно, что эти различия в быстроте вы-скальзывания нормальных и анормальных автоматических импульсов
следует учитывать в клинике при дифференциальной диагностике двух типов автоматизма. Правда, если сверхчастая стимуляция длится больше 15 с, то автоматизм гиполя-ризованных волокон Пуркиньо тоже оказывается несколько подавленным IDangman К., Hoi'fman В., 198,4; Ro-son M., 1986, 1988].
Реакция неизмененных и гипополяризованных волокон Пуркинье в ответ на одиночный преждевременный экстрастимул имеет общую направленность, однако в количественном отношении она неодинакова. В нормальных волокнах Пуркинье автоматизм временно прерывается с удлинением первого, возвратного, цикла на 30% по отношению к исходной длине цикла. В гипополяризованных волокнах возвратный цикл равен исходному циклу либо лишь слегка длиннее его. В части случаев преждевременные экстрастимулы, попадающие в определенную фазу автоматического цикла, могут вызвать аннигиляцию анормального водителя ритма, т. е. его устранение с внезапным прекращением выработки импульсов. В последующем функция анормального автоматического центра восстанавливается медленно и постепенно. «Аннигиляции» придается, с современной точки зрения, большое значение при объяснении интер-миттирования парасистолии [Jalife J., Anl/elevitchC., 1980].
Допускается, что анормальный автоматизм может быть причиной возникновения не только парасистолип, но и некоторых форм очаговых пред-сердньтх тахикардии, ускоренных ритмов. Возможно, что такой же механизм лежит в основе одной из разновидностей желудочковой тахикардии (ЖТ) в остром тгериоде инфаркта миокарда.
Это относится к очаговой автоматической ЖТ с частотой ритма ^200 в 1 мин, поскольку физиологический автоматизм волокон Пуркинье не может, как уже упоминалось, достигать столь высокого уровня [Crane-field Р., 1975].
ПОСТДЕПОЛЯРИЗАЦИИ И ТРИГГЕРНАЯ (НАВЕДЕННАЯ, ПУСКОВАЯ) АКТИВНОСТЬ
Двумя процессами, названными ностдеполяризациями (afterdepolari-/ations), представлены формы нарушенного образования импульса, но связанные с автоматическими, т. е. самогенерирующими механизмами. Постдеполяризации — это вторичные подпороговые деполяризации (осцилляции мембранного потенциала), которые могут появляться: а) во время 2 и 3 фаз реполяризации ПД — их называют ранними постдеполяризациями; б) непосредственно после окончания ПД — их называют задержанными, или замедленными, постдеполяризациями [Cranefield P., 1975, 1977].
Ранние постдеполяризации..Можно указать два важнейших условия их возникновения и связанных с ними трштерных ритмов. Первое условие: остановка или замедление реполяри-аации ПД, который начинается от достаточно большого потенциала покоя (между 75 и 90 мВ). Как показали В. Damiano и М. Rosen (1984), изучавшие влияние цезия хлорида на ПД волокон Пуркинье собаки, существуют два подвида ранних постдеполяризаций. Одни из них формируются при задержке реполяризации в фазе 2 ПД, т. е. на уровне мембранных потенциалов от —3 до —ЗОмВ. Другие появляются при задержке реполяризации в фазе 3 ПД, т. е. на уровне мембранных потенциалов от —50 до —70 мВ (рис. 9, 10). Напомним, что при таком же уровне потенциала мембраны может возникнуть анормальная спонтанная диастолическая деполяризация. Однако анормальный автоматизм—следствие частичной деполяризации мембраны, тогда как ранние иостдеполяризации — результат ее неполной реполяризации.
Второе условие возникновения ранних постдеполяризаций и трштерных ритмов — урежепие основного ритма или частоты искусственной

Рис. 10. Ранние постдеиоляризации. Влияние длины цикла стимуляции (CL) на вон иикшшоние ранних ностдшюляризаций и трштерного ритма: но море, удлинения цикла возрастает число ранних лостденоля-риуаций (но В. Damiano, M. Rosen).
стимуляции. В эксперименте можно видеть, как при остановке реполяризации в фазе 2 или 3 ПД сначала регистрируются низкоамплитудные под-пороговые колебания мембранного потенциала, направленные кверху, т. е. в сторону более положительных потенциалов. Если частота основного ритма понижается, то происходит постепенное возрастание амплитуды ранних постдеполяризаций (в основном второго подвида). Достигнув порога возбуждения, одна из них вызывает образование нового ПД еще до окончания исходного ПД. Этот преждевременный ПД рассматривается
как триггерный, наведенный, ш>~ скольку он обязан своим возникновением ранней постдеполяризации, исходящей от основного ПД. В свою очередь, второй (наведенный) ПД может за счет своей ранней постдеполяризации вызвать третий, тоже триггерный ПД, а третий ПД стимулирует четвертый триггерный ПД и т. д. Следовательно, закрепляется пусковая ритмическая активность клеточной мембраны с различным числом импульсов. Надо учитывать, что при чрезмерном урежении основного ритма (или частоты стимуляции) амплитуда ранних постдеполяризаций начинает понижаться, и вероятность появления триггерного ритма уменьшается [Rosen M., 1986].
Триггерный ритм, вызванный ранними постдеполяризациями, не подвергается сверхчастому подавлению при коротком периоде стимуляции, но он может быть подавлен при более продолжительном периоде сверх частой стимуляция. Преждевременным экстрастимулом удается устранить такой триггерный ритм, если происходит гиперполяризация мембраны. В общем, триггерные ритмы этого типа исчезают в тот момент, когда по какой-либо причине полностью завершается процесс реполяризации, т. е. мембранный потенциал возвращается к своей максимальной физиологической величине (75—90 мВ).
Естественно, возникает вопрос о причинах, ведущих к задержке реполяризации, образованию ранних постдеполяризаций и триггерных ПД. Ответ мы находим в исследованиях D. Gadsby и P. Granefield (1977), обнаруживших два уровня мембранного потенциала, при которых волокнам Пуркинье свойственна устойчивая электрическая активность. Первый уровень равен —90 мВ, т. е. нормальному потенциалу покоя. Второй уровень соответствует —60 мВ, т. е. зоне триггерной активности. Остановка ре-поляризации на последнем уровне и образование ранних постдеполяризаций являются, согласно экспериментальным данным В. Damiano, M. Ro-
sen (1984), характерным ответом клеток на различные факторы: гиперка-техолемию, гипокалиемию, ацидоз, гипокальциемию, ишемию, воздействие аконитина, N-ацетилновокаина-мида, соталола, цезия хлорида и др. Перерастяжение волокон Пуркинье при большом расширении или аневризме левого желудочка тоже создает условия для триггерных возбуждений.
Полагают, что следствием этих влияний бывает усиление входящего устойчивого деполяризующего тока, чувствительного к ТТХ (так называемого «тока Na+ окна») в фазе плато с удлинением ПД, вместе с торможением фазы 3 реполяризации, что, по-видимому, зависит от изменений тока ik, [Coulombe A. et al., 1985]. Еще раньше P. Cranefield (1977) показал, что колебания потенциала в фазах 2 и 3 реноляризации удается подавить верапамилом; в этом факте проявляется связь ранних постдеполяризаций с электрогенным Na—Са-обменным механизмом [Fischmeister R., Vas-sort G., 1981] и, возможно, с усилением входящего Са++-тока [January С. et al., 1988]. По последним данным, ранние постдеполяризации на уровне потенциалов от 0 до —30 мВ связаны с входящим Са++ током, переносимым через мембранные каналы L-типа [January С., Riddle J., 1989].
Что касается клинического значения ранних постдеполяризаций, то о нем можно судить по результатам исследований J. Brachmann и соавт. (1983). С помощью цезия хлорида они вызывали у собак синусовую бра-дикардию, удлинение интервала Q— Т и плеоморфную ЖТ. Авторы предполагают, что некоторые формы тахи-аритмий у больных с удлинением интервала Q—Т имеют триггерную природу. С. Mendez, M. Delmar (1985) подчеркивают роль этого механизма и формировании парасистолических очагов.
Задержанные постдеполяризации. Это электрические осцилляции в фазе 4 ПД, которым, как правило, предшествует гиперполяризация клеточ-

|
ной мембраны [Cranefield P., 1977]. Они изучены лучше, чем ранние постдеполяризации. Последовательность событий здесь такая же, как и при ранних постдеполяризациях. Подпо-роговое, демпфированное колебание мембранного потенциала себя не проявляет. Если же его амплитуда возрастает, достигая порога возбуждения, то возникает наведенный импульс—новый, преждевременный ПД (рис. 11). Этот ПД может, в свою очередь, быть источником другой пороговой осцилляции — ПД и т. п. В конечном счете формируется цепь триггер-ных возбуждений.
В эксперименте отмечено, что увеличение амплитуды задержанных ностдеполяризаций происходит тогда, когда в клетках повышается концентрация ионов Caf+. Медленный входящий Са++-ток не втянут непосредственно в этот процесс. Задержанные постдеполяризации генерируются «транзиторным входящим током», (iti), переносимым ионами Na+ и частично К+, но регулируемым внутриклеточной концентрацией ионов Са++, на которую влияет вхождение ионов Са++ в клетку [Marban E., Tsi-en R., 1982; Marban E., Smith Т., 1986; Gintant G., 1988].
Триггерную активность, вызываемую задержанными постдеполяризациями, изучали в волокнах Пуркинье, на которые воздействовали токсическими дозами сердечных гликозидов [Verrier G., 1977; Moak J., Rosen M., 1984], в предсердных клетках коро-
нарного синуса, обработанных кате-холаминами [Wit A., Cranefield P., 1977; Wit A. et al., 1981], при экспериментальном инфаркте миокарда [Le Marek H. et al., 1985; Kimura S. et al., 1987], в предсердных и желудочковых волокнах человека in vitro [Dangman К. et al., 1982]. В 1988 г. S. Priori и соавт. впервые продемонстрировали in vivo (у кошек), что задержанные постдеполяризации можно вызвать путем раздражения левого звездчатого ганглия.
В отличие от ранних постдеполяризаций, возникновению (усилению) которых способствует брадикардия, задержанные постдеполяризации стимулируются учащением сердечного ритма. Это, по-видимому, происходит при синусовой тахикардии у больных с гипертрофией левого желудочка, кардиомиопатиями, ишемией миокарда. Вероятно, такой же характер носит «триггерный взрыв» — возникновение осцилляторной активности у некоторых больных вслед за периодом сверхчастой или программированной электрической стимуляции сердца [Wit A., Rosen M., 1983]. Весьма вероятно, что триггерную природу имеют ЖТ, вызываемые физической нагрузкой у больных без ИБС и других органических заболеваний сердца (см. стр. 309).
Триггерные ритмы, связанные с интоксикацией дигиталисом (волокна Пуркинье) и зависящие от воздействия адреналина на предсердные клетки коронарного синуса, имеют как
сходство, так и различия [Johnson N. el a)., 1986]. В лервом случае, по-видимому, сразу же устанавливается постоянная частота эктопического ритма; во-втором — отмечается постепенное укорочение длины циклов, т. е. «разогрев» ритма с последующей его стабилизацией. Дигиталисно-токсиче-ские триггерные ритмы могут прерываться остро. Триггерный ритм, исходящий из коронарного синуса, замедляется постепенно («охлаждение») до момента исчезновения. Правда, эти факты еще нуждаются в дальнейшем клиническом подтверждении.
Имеет смысл рассмотреть некоторые вопросы дифференциальной диагностики триггер-ных, анормальных автоматических и реципрокных (re-entry) ритмов в экспериментальной работе и в процессе клинических электрофизиологических исследований. Пока эта проблема не может считаться решенной, но мы усматриваем определенную пользу в систематизации имеющихся в литературе электрофизиологических данных, что должно приблизить нас к распознаванию механизмов аритмий у больных. Что касается задержанных постдеполяризаций и триггер-ных ритмов, то мы использовали в основном результаты, получаемые при дигиталисной интоксикации [Johnson N. et al., 1986; Rosen M., 1986, 1988]:
а) задержанные постдеполяризации (триггерные ритмы) могут быть вызваны одним-двумя преждевременными экстрастимулами, т. е. тем же приемом, что и re-enlry. Однако воспроизводимость тригтерных ритмов при достижении критического интервала экстрастимула обычно ниже 30% (в волокнах Пуркинье), тогда как воспроизводимость re-entry высока [Moak J., Roscn M., 1984]. Кроме того, длина возвратного цикла вслед за преждевременным экстрастимулом, вызвавшим задержанные постдеполяризации, укорачивается по мере уменьшения интервала сцепления экстрастимула (прямая зависимость). При re-entry зависимость об-
ратная: интервал между экстрастимулом и первым тахикардическим комплексом удлиняется при укорочении интервала сцепления преждевременного экстрастимула. Это — важный признак re-entry [Rosen M., 1986, 1988]. С помощью преждевременных экстрастимулов не удается генерировать анормальную автоматическую активность;
б) задержанные постдеполяризации (триггерные ритмы) значительно легче прерываются под воздействием одиночных преждевременных экстрастимулов, чем анормальные автоматические ритмы. Подавление триггерных ритмов, формирующихся в волокнах Пуркинье периинфаркт-ной зоны, достигается более легко с помощью ранних экстрастимулов, чем поздних [El-Sherif N. et al., 1983; Dangman K., Hoffman В., 1985]. Триг-герная активность в мышечных волокнах митрального клапана в равной степени устраняется как ранними, так и поздними экстрастимулами [Wit A., Cranefield P., 1976];
в) электрическая стимуляция длительностью 15 с и длиной цикла около 300 мс быстро прерывает триггерные ритмы, в основе которых лежат задержанные постдеполяризации, например дигиталисно-токсические, но она слабее влияет на анормальные автоматические ритмы, как, впрочем, и на триггерные ритмы, зависящие от ранних постдеполяризаций [Rosen M., 1986].
Еще одно замечание имеет отношение к терминологии. В литературе нередко можно встретить термин «триггерный автоматизм», что, по сути дела, неверно, так как триггерные (наведенные) ритмы не связаны со спонтанной диастолической деполяризацией — автоматизмом.
НАРУШЕНИЯ ПРОВОДИМОСТИ
Движение импульса в сердечном волокне зависит от нескольких взаимодействующих факторов: силы электрического стимула — ПД в возбуж-
денном участке волокна, электрического ответа соседнего еще не возбудившегося участка волокна, межклеточного электротонического взаимодействия, пассивных свойств клеточных мембран, анатомических особенностей строения волокон (их величины, типа, геометрии, направленности). Изменения каждого из этих факторов могут приводить к нарушениям проводимости [Gettes L. et al., 1985].
Нередко причиной медленного проведения или блокады бывает снижение потенциала покоя (максимального диастолического потенциала) в клетках, которым в нормальных условиях свойствен быстрый электрический ответ (клетки Пуркинье, сократительные клетки предсердий и желудочков). Скорость проведения импульса в этих клетках непосредственно связана с крутизной и амплитудой фазы О ПД, т. е. с такими характеристиками, которые определяются процентом открытых быстрых Na каналов мембраны в момент возбуждения и натриевым электрохимическим градиентом (соотношение вне- и внутриклеточной концентраций ионов Na+). В свою очередь, существует тесная зависимость между процентом Na каналов, способных к открытию, и величиной максимального диастоличе-ческого потенциала мембраны. Если под влиянием патологических воздействий он понижается, уменьшается и ПД, соответственно замедляется проведение импульса. Потенциал действия со сниженной фазой 0 за счет инактивации быстрых Na каналов мембраны отражает «подавленный быстрый ответ». При уменьшении потенциала покоя до уровня —50 мВ инактивируется около 50% Na каналов, и возбуждение (проведение) становится невозможным. Возникающие блокады могут быть как однонаправленными, так и двунаправленными.
В части случаев, даже при значительном уменьшении потенциала покоя, проведение импульса сохраняется, правда, резко замедленное. Воз-
буждение клеток, т. е. регенеративная деполяризация мембраны, обеспечивается в этих условиях медленными входящими Са++- и Na+-TOKa-ми, поскольку медленные Са, Са — Na и Na каналы мембраны устойчивы к снижению потенциала покоя. «Быстрые» клетки превращаются в «медленные» клетки с выраженным торможением скорости проведения или с возникновением блокады.
Одной из форм нарушенной проводимости является декрементное (затухающее) проведение, т. е. прогрессирующее замедление проведения в сердечном волокне, по длинни-ку которого постепенно снижается эффективность стимула (ПД) и (или) возбудимость ткани. Этот процесс обычно развертывается в функционально подавленных волокнах, на что обратил внимание еще J. Erlanger (1906), впервые выдвинувший концепцию о декрементном проведении. В 1928 г. F. Schmitt и J. Erlanger предложили модель декрементного проведения: на длинную мышечную полоску, вырезанную из желудочка черепахи, они воздействовали раствором, содержавшим высокую концентрацию ионов К+. Вероятно, такой же характер носят нарушения проводимости в волокнах Пуркинье, сохранившихся после экспериментального инфаркта миокарда, а также блокады в местах соединения волокон Пуркинье с мышечными сократительными волокнами [Bigger J., 1980; Gil-mour R. et al., 1985].
Другая форма нарушенной проводимости представлена неравномерным проведением. Если в параллельно расположенных сердечных волокнах проведение становится декре-ментным, но не в одинаковой степени, то вместо единого фронта возбуждения появляются опережающие и запаздывающие волны. Деполяризация соседних волокон происходит неодновременно, общая эффективность стимула падает, и возможно развитие частичной или полной блокады его проведения.
В 80-х годах рядом авторов подчер-
кивается значение неравномерностеи в распределении межклеточных соединений для возникновения нарушений проводимости [Spach M. et al., 1981, 1982, 1986]. Основанием для такого вывода послужили данные об анизотропности сердечной мышцы и связанным с ней более быстрым проведением импульса вдоль, чем поперек мышечного волокна. Соответственно, общее время открытия Na каналов оказывается более продолжительным, когда импульс проводится вдоль волокна, чем поперек его. Такого же рода неравномерности проявляются в тех участках, где мышечные пучки разветвляются пли соединяются с другими пучками, что и в норме приводит к внезапному замедлению ПД. В патологических условиях при ослаблении деполяризующего тока или межклеточных связей здесь могут возникать блокады.
Гипотеза, развиваемая G. Мое и сотр. [Antzelevitch С., Мое G., 1981; Antzelevitch С. el al., 1985], основывается на многочисленных экспериментальных данных, показывающих, что электротоническое взаимодействие между двумя возбудимыми участками, разделенными небольшой зоной высокого сопротивления, сопровождается резким замедлением проводимости в дистальном участке волокна. Такие факторы, как ограниченная ишемия миокарда, местная высокая концентрация ионов К+, локальное сдавление или охлаждение и другие воздействия могут вызвать невозбудимость небольшого сегмента в сердечном волокне (волокне Пуркинье) и тем самым способствовать электро-тонически опосредованному ступенчатому торможению передачи импульса через невозбудимую зону. По мнению С. Antzelevilch и соавт. (1985), этот механизм играет даже более важную роль в развитии частичных или полных блокад в сердце человека, чем изменения амплитуды ПД или скорости возрастания его фазы 0 (электрический ответ).
Мы кратко рассмотрели особенности механизмов блокирования им-
пульсов. При изложении отдельных форм аритмий будет уделено внимание таким нарушениям, как скрытое проведение, однонаправленные блокады и др. Непосредственное отношение к расстройствам проводимости имеет и повторный вход импульса (re-entry).
ПОВТОРНЫЙ ВХОД ИМПУЛЬСА (RE-ENTRY) И ЕГО КРУГОВОЕ ДВИЖЕНИЕ (CIRCUS MOVEMENT)
Как возможный механизм сердечных аритмий re-entry было распознано еще в начале XX в. [Мауег А., 1906, 1908; Mines G., 1913, 1914; Car-rey W., 1914]. Этим термином обозначают явление, при котором импульс, совершающий движение по замкнутому пути (петле, кругу, кольцу), возвращается к месту своего возникновения и повторяет движение (рис. 12). Фундаментальное изучение re-entry было предпринято F. Schmitt, J. Erlanger (1928) в уже упоминавшихся нами опытах с мышечной полоской из желудочка черепахи, подвергнутой воздействию давления, холода или раствора с высокой концентрацией ионов К+. Авторы, в частности, предположили, что избыток ионов К 1~ в наружной среде вызывает продольное разделение мышцы на два пути с антероградной блокадой проведения по одному из них. Искусственный стимул распространяется аптероградно по другому пути, а затем ретроградно продвигается по ранее блокированному пути к месту стимуляции. Это было первое четкое упоминание о возможности однонаправленного блокирования. Схемы повторного входа, предложенные исследователями для разветвленного и неразветвленного волокна, воспроизводятся с небольшими изменениями на рис. 13.
|
Просмотров 746 |
|
|
