
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Производные фолиевой кислоты
|
|
Структурным аналогом и антагонистом кислоты фолиевой является метотрексат (табл. 68.2). При создании метотрексата был использован принцип подражания естественным метаболитам для поиска противоопухолевых средств. Метотрексат представляет собой смесь 4-дезокси-4-амино-N-10-метилфолиевой кислоты и других птериновых соединений. Синтез основного компонента метотрексата практически идентичен получению кислоты фолиевой (см). Отличие состоит в использовании для трехкомпонентной конденсации тетрааминопиримидина, трихлорацетона и N-[4-(N-метиламинобензоил)] глутамата бария:
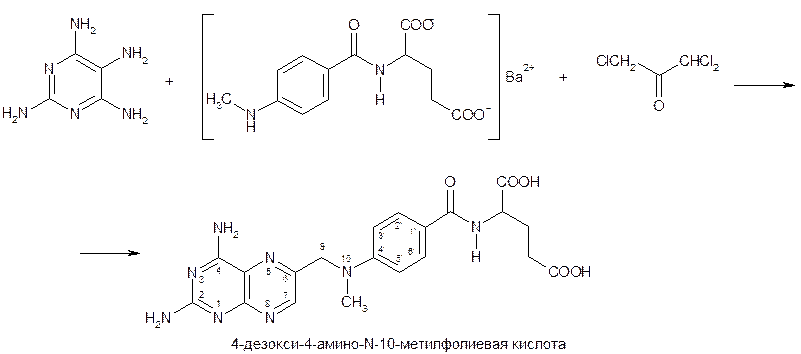
68.2. Свойства метотрексата
| Лекарственное вещество | Описание |
| Methotrexate— метотрексат | Желтый или оранжево-желтый мелкокристаллический порошок. Удельное вращение от +19 до +24° (1%-ный раствор в растворе карбоната натрия) |
Подобно кислоте фолиевой метотрексат практически нерастворим в воде, этаноле, дихлорэтане, эфире, но легко растворим в разведенных растворах щелочей и карбонатов.
Подлинность метотрексата устанавливают по ИК- и УФ-спектрам поглощения. ИК-спектр должен соответствовать спектру сравнения, а УФ-спектр 0,001%-ного раствора в 0,1 М растворе гидроксида натрия в области 240-400 нм должен иметь три максимума поглощения при 258, 303 и 370 нм. Отношение оптических плотностей при 303 и 370 нм должно составлять 2,8–3,3. Метотрексат подобно кислоте фолиевой окисляется перманганатом калия, образуя голубую флуоресценцию в УФ-свете. В качестве окислителя используют также калия хлорат.
Для установления подлинности используют бумажную хроматографию (хроматографическая бумага — Ленинградская «С» 6x30). Наносят на линию старта раствор метотрексата и кислоты фолиевой, хроматографируют в защищенной от света камере с фосфатным буфером (рH 5,75–5,85). Затем сушат и просматривают в УФ-свете при 254 нм. По отношению к пятну кислоты фолиевой обнаруживают и устанавливают величину Rs метотрексата и наличие не более трех флуоресцирующих пятен других птериновых соединений.
Аналогично, но с точной навеской метотрексата выполняют количественное определение, сочетая бумажную хроматографию с УФ-спектрофотометрией (хроматоспектрофотометрия). После хроматографирования испытуемого вещества и ГСО кислоты фолиевой вырезают зоны с пятнами метотрексата, кислоты фолиевой и из полоски бумаги (для контрольного опыта). Бумагу с зонами измельчают, элюируют 0,1 М раствором гидроксида натрия по 3 раза каждую пробу. Элюаты сливают в мерные колбы, доводят до метки и спектрофотометрируют относительно контрольного раствора (элюат из чистой полосы хроматографической бумаги) элюат метотрексата при 258 нм, а кислоты фолиевой — при 256 нм. Расчет содержания метотрексата (не менее 90%) выполняют по формуле с помощью величин оптических плотностей и коэффициента пересчета.
Количественное определение можно выполнить (МФ) методом ВЭЖХ, используя колонку высотой 10 см, внутренним диаметром 6 мм, заполненную силикагелем с октадецилсилильным покрытием. В качестве подвижной фазы берут смесь ацетонитрила и фосфатно-цитратного буфера (8:92). Детектором служит УФ-спектрофотометр (при длине волны 303 нм). Расчет содержания выполняют по площадям пиков испытуемого и стандартного образцов.
Хранят метотрексат по списку Б, в плотно укупоренной таре, предохраняющей от действия света, в сухом месте при температуре от +5 до +10°C. Необходимо осторожно обращаться с метотрексатом, избегая попадания его на кожу и слизистые. Метотрексат — цитостатическое (противоопухолевое) средство. Применяют его для лечения острых лейкозов, при злокачественных заболеваниях матки, молочной железы, раке легкого и др. Назначают внутрь в таблетках по 0,0025 г, а также внутримышечно и внутривенно.
ГЛАВА 69.
ПРОИЗВОДНЫЕ ИЗОАЛЛОКСАЗИНА
Гетероциклическая система изоаллоксазин подобно птеридину включает два гетероцикла: пиразин и пиримидин, но содержит еще бензольный цикл, т.е. является частично гидрированным производным бензоптеридина. Пиримидиновое ядро изоаллоксазина имеет характер лактамного цикла:

К витаминам комплекса B относятся так называемые флавиновые витамины (от слова flavum — желтый). Они содержатся в дрожжах, молочной сыворотке, мясе, рыбе, печени, почках, яичном белке, зародышах и оболочках зерновых культур (ячмене, пшенице), горохе, овощах (шпинате, томатах). Выделенные из молока (лактофлавин), яичного белка (овофлавин), лимонов (цитрофлавин), вещества оказались идентичными по химической структуре. Они содержат в молекуле гетероциклическую систему — изоаллоксазин, остаток рибозы и представляют собой рибофлавин. Рибофлавин имеет характерную желто-оранжевую окраску, обусловленную несколькими сопряженными связями в молекуле.
Проявление витаминной активности во флавиновой системе связано с наличием в молекуле чрезвычайно лабильной азадиеновой группировки с двумя сопряженными двойными связями (в изоаллоксазиновом ядре). Эта группировка обусловливает окислительно-восстановительные свойства рибофлавина. Благодаря наличию этих свойств флавины выполняют в организме многообразные биологические функции, участвуя в реакциях метаболизма углеводов, липидов и белков. При восстановлении рибофлавин, теряя желтую окраску, переходит в бесцветный лейкорибофлавин. Последующее окисление обусловливает обратный процесс:
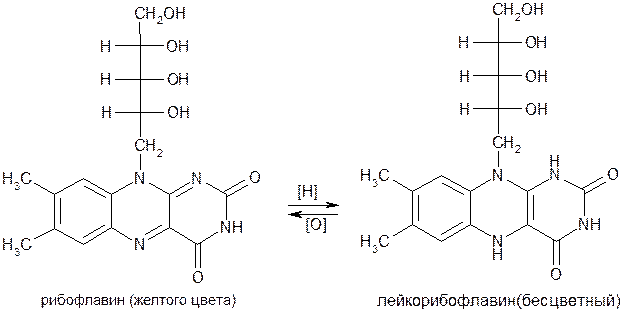
На витаминную активность оказывает влияние также наличие в молекуле рибитильного радикала. Характерная особенность рибофлавина — его светочувствительность. Под влиянием света происходят изменения в химической структуре рибофлавина. Они зависят как от интенсивности облучения, так и от рH среды. При действии света в нейтральной или слабокислой среде происходит частичное или полное отщепление остатка рибозы с образованием люмихрома, имеющего желтое окрашивание, но не флуоресцирующего. В щелочной среде при облучении раствора рибофлавина образуется в основном люмифлавин (и частично люмихром):

Люмихром и люмифлавин витаминной активности не проявляют.
Люмифлавин в растворах имеет окрашивание и флуоресценцию, аналогичные рибофлавину, но отличается от него тем, что растворяется в хлороформе. Это свойство используют для обнаружения примеси люмифлавина в рибофлавине и в рибофлавина-мононуклеотиде.
Рибофлавин можно получить из животного или растительного сырья. Однако процесс этот трудоемок и дает очень низкий выход. Чтобы выделить 1,0 г рибофлавина, нужно переработать 5,4 т молочной сыворотки.
В промышленности рибофлавин синтезируют путем конденсации 3,4-диметиланилина с D-рибозой. Полученный имин гидрируют, затем через реакцию азосочетания (с восстановлением азогруппы) образуют арилрибамин и конденсируют его с аллоксаном:

В настоящее время рибофлавин получают с помощью микробиологического синтеза. Использование современных достижений в области физиологии микроорганизмов и генной инженерии позволило увеличить выход при биосинтезе рибофлавина в 4–5 тысяч раз.
В медицинской практике применяют рибофлавин и рибофлавина мононуклеотид. Оба сходны по внешнему виду, но различаются по удельному вращению (табл. 69.1).
69.1. Свойства производных изоаллоксазина
| Лекарственное вещество | Химическая структура | Описание |
| Riboflavin— рибофлавин |
 6,7-диметил-9-(D-1-рибитил)-изоаллоксазин
6,7-диметил-9-(D-1-рибитил)-изоаллоксазин
| Желто-оранжевый кристаллический порошок со слабым специфическим запахом. На свету неустойчив. Удельное вращение от –115 до –135° (0,5%-ный раствор в спиртовом растворе гидроксида калия) |
| Riboflavin–mononucleotide— рибофлавина-мононуклеотид |  натриевая соль 6,7-диметил-9-(1-D-рибитил)изоаллоксазин-5`-фосфата дигидрата
натриевая соль 6,7-диметил-9-(1-D-рибитил)изоаллоксазин-5`-фосфата дигидрата
| Желто-оранжевый кристаллический порошок, без запаха. На свету неустойчив. Гигроскопичен. Удельное вращение от +37 до +43° (1,5%-ный раствор в 5 М растворе хлороводородной кислоты) |
Рибофлавин медленно растворим в воде (1 г в 15000-25000 мл), а рибофлавина-мононуклеотид растворим в воде. Оба практически нерастворимы в этаноле и хлороформе. Рибофлавин растворим в растворах кислот и щелочей, т.к. является амфотерным соединением. Его кислотные свойства обусловлены наличием подвижного атома водорода имидной группы, а основные — наличием нескольких гетероциклических атомов азота.
Идентифицировать рибофлавин можно по ИК-спектру, который должен соответствовать спектру, полученному с его стандартным образцом, или спектру сравнения (МФ). Для испытаний производных изоаллоксазина используют химические реакции, основанные на окислительно-восстановительных свойствах сопряженных двойных связей, окислении и этерификации рибитильной части молекулы, комплексообразовании, гидролизе, наличии в молекуле третичного атома азота, иона натрия и связанной фосфорной кислоты.
Подлинность рибофлавина устанавливают по характерной яркой зеленовато-желтой окраске и интенсивной зеленой флуоресценции водного раствора (в ультрафиолетовом излучении). Флуоресценция исчезает при добавлении растворов хлороводородной кислоты или щелочи. Если к водному раствору рибофлавина прибавить гидросульфит натрия (сильный восстановитель), то окраска и флуоресценция исчезают вследствие образования лейкорибофлавина (химизм см. выше). Свойство флуоресцировать используют для флуориметрического определения рибофлавина.
Желто-зеленую флуоресценцию наблюдают в ультрафиолетовом свете при длине волны 254 нм у водного 0,1%-ного раствора рибофлавина-мононуклеотида. Она исчезает при добавлении 1%-ного раствора гидроксида натрия или разведенной хлороводородной кислоты.
Рибофлавина-мононуклеотид в отличие от рибофлавина дает положительную реакцию на ион натрия и на фосфаты, которые образуются после кипячения в течение 5 мин раствора в концентрированной азотной кислоте. Кроме того, определяют (без разрушения) содержание примеси фосфорной кислоты (не более 0,7%) спектрофотометрическим методом, используя в качестве реактива молибдат аммония при длине волны 740 нм.
В качестве реактива используют также концентрированную серную кислоту, от которой при смачивании крупинка рибофлавина приобретает вишнево-красное окрашивание. Раствор нингидрина при кипячении в щелочной среде образует в присутствии рибофлавина зеленую окраску. Как азотсодержащее органическое основание, рибофлавин дает положительную реакцию с реактивом Драгендорфа и другими общеалкалоидными (осадительными) реактивами. С солями металлов (серебра, кобальта, меди, ртути и др.) рибофлавин образует нерастворимые окрашенные комплексные соединения. Например, с раствором нитрата серебра — оранжево-красного, переходящего в красный, а с солями ртути (II) — оранжевого цвета. Эти реакции используют для фотоколориметрического определения рибофлавина в лекарственных формах.
В рибофлавине и рибофлавина-мононуклеотиде устанавливают допустимое содержание примеси люмифлавина путем извлечения его хлороформом. Затем либо измеряют его оптическую плотность относительно хлороформа при длине волны 440 нм (рибофлавин), либо сравнивают окраску хлороформного извлечения относительно раствора дихромата калия определенной концентрации (рибофлавина-мононуклеотид).
Для качественного и количественного анализа применяют спектрофотометрию в УФ-области. Все испытания выполняют, защищая испытуемые лекарственные вещества от попадания прямого солнечного света. В водных растворах рибофлавин имеет 4 максимума поглощения (223, 267, 370 и 445 нм). Используя в качестве растворителя воду с добавлением уксусной кислоты и ацетата натрия, выполняют спектрофотометрическое определение рибофлавина при длине волны 267 нм. Тот же растворитель берут для растворения навески рибофлавина-мононуклеотида в мерной колбе и последовательного выполнения нескольких испытаний. Подлинность подтверждают по УФ-спектру полученного раствора рибофлавина-мононуклеотида, который имеет три максимума светопоглощения при 266, 373 и 445 нм. И в том же растворе спектрофотометрическим методом количественно определяют при длине волны 445 нм содержание рибофлавина-мононуклеотида. В аналогичных условиях проводят количественное определение рибофлавина (ФС). Расчет выполняют по удельному показателю поглощения (328) рибофлавина при длине волны 444 нм, а затем умножают на коэффициент пересчета. МФ рекомендует для этой цели использовать стандартный образец.
Растворы, приготовленные для количественного спектрофотометрического определения, используют для установления в рибофлавине допустимого содержания светопоглощающих примесей. С этой целью измеряют оптическую плотность указанных растворов рибофлавина в максимумах при длинах волн 267 нм, 373 нм, 444 нм. Отношение оптических плотностей при 373 нм и 267 нм должно быть в пределах от 0,31 до 0,33, а при 444 нм и 267 нм — от 0,36 до 0,39. Допустимое содержание поглощающих примесей в рибофлавина-мононуклеотиде устанавливают, измерив оптическую плотность его раствора при длинах волн 373 нм, 266 нм и 445 нм. Отношение этих величин при 373 и 445 нм должно быть от 0,83 до 0,86, а при 266 и 445 нм — от 2,5 до 2,75.
Способы количественного определения титриметрическими методами основаны на использовании кислотно-основных и окислительно-восстановительных свойств.
Для количественного определения применяют алкалиметрическое определение рибофлавина после его реакции с нитратом серебра, а также цериметрию с иодометрическим окончанием и метод Кьельдаля (содержание азота 14,5– 15,2%). Предполагают, что под действием нитрата серебра происходит замещение водорода иминогруппы ионом серебра с выделением эквивалентного количества азотной кислоты, которую оттитровывают щелочью (индикатор бромтимоловый синий). При цериметрическом определении 0,02 М раствором сульфата церия (IV) окисляют рибофлавин при кипячении (в течение 1 минуты). Затем после охлаждения добавляют иодид калия и титруют выделившийся иод.
Селективными, позволяющими количественно определять содержание рибофлавина, являются методики, базирующиеся на реакциях по рибитильному радикалу, влияющему на витаминную активность.
Одна из таких методик основана на окислении рибофлавина 0,02 М раствором периодата калия в нейтральной среде при комнатной температуре с образованием муравьиной кислоты. Ее количество эквивалентно взятому на определение рибофлавину:

Выделившуюся муравьиную кислоту оттитровывают алкалиметрическим методом:
2HCOOH + 2NaOH → 2HCOONa + 2H2O
Второй способ определения рибофлавина по рибитильной части молекулы основан на этерификации концентрированной серной кислотой. При этом за счет гидроксильных групп происходит образование моно-, ди-, три-, тетрасульфокислотных эфиров. Затем потенциометрическим титрованием раствором гидроксида калия устанавливают избыток серной кислоты. Реакция протекает стехиометрически в соотношении 1:3.
Рибофлавин необходимо хранить в хорошо укупоренных банках оранжевого стекла, учитывая его свойство легко окисляться и разлагаться под действием света с образованием биологически неактивных люмихрома и люмифлавина. Рибофлавина-мононуклеотид более устойчив, поэтому его хранят в сухом, защищенном от света месте.
Рибофлавин восполняет недостаток витамина B2 в организме. Особенно он важен для нормальной функции зрения. Назначают внутрь в таблетках и драже по 0,005-0,01 г при гипо- и авитаминозе, различных глазных заболеваниях, длительно не заживающих ранах и язвах, лучевой болезни, болезни Боткина и т.д. Рибофлавина мононуклеотид при тех же заболеваниях вводят внутримышечно по 1 мл 2%-ного раствора, а в офтальмологии применяют 1%-ные растворы.
ГЛАВА 70.
ПРОИЗВОДНЫЕ ФЕНОТИАЗИНА
|
Просмотров 5999 |
|
|
