
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Производные 1,5-бензотиазепина
|
|
Бензотиазепин отличается от 1,4-бензодиазепина наличием в положении 1 атома серы вместо азота и расположением гетероатомов:

Применяют лекарственное вещество дилтиазема гидрохлорид, имеющее ряд заместителей (метоксифенил-, ацетокси- и диметиламиноэтил-) в структуре 1,5-бензотиазепина (табл. 71.6).
Для формирования тиазепинового цикла синтезируют оксиран из о-метоксибензальдегида и этилового эфира хлоруксусной кислоты. Затем проводят циклоконденсацию оксирана с о-аминотиофенолом. В полученном бензотиазепине ацетилируют гидроксил и алкилируют амидный атом азота N,N’-диметиламиноэтилхлоридом:

71.6. Свойства дилтиазема гидрохлорида
| Лекарственное вещество | Химическая структура | Описание |
| Diltiazem Hydrochloride— дилтиазема гидрохлорид (Дилзем) |
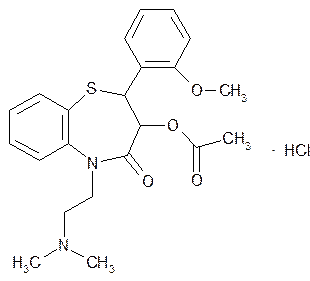 D-цис—3-ацетокси-2,3-дигидро-5-[2-(диметиламино)-этил]-2-(2-метоксифенил)-1,5-бензотиазепин-4(5H)-она гидрохлорид
D-цис—3-ацетокси-2,3-дигидро-5-[2-(диметиламино)-этил]-2-(2-метоксифенил)-1,5-бензотиазепин-4(5H)-она гидрохлорид
| Белый кристаллический порошок или тонкие кристаллы без запаха. Т.пл. 210 °C (с разложением). Удельное вращение от +110 до +116° (1%-ный водный раствор) |
Дилтиазема гидрохлорид (табл. 61.6) — белое кристаллическое вещество, растворимое в воде, метаноле, хлороформе, муравьиной кислоте, нерастворимое в эфире.
Фармакопея США рекомендует при испытании на подлинность подтверждать наличие хлорид-иона и измерять ИК-спектр, сравнивая его со стандартным образцом. Для испытания подлинности и количественного определения дилтиазема гидрохлорида рекомендован метод ВЭЖХ.
Количественное определение выполняют, используя стандартный раствор дилтиазема и подвижную фазу, содержащую буферный раствор (смесь камфоросульфоновой кислоты, ацетата натрия и гидроксида натрия до pH 6,2)-ацетонитрил-метанол (50:25:25). Детектируют в УФ-области при 240 нм.
Подлинность дилтиазема в капсулах устанавливают методом ТСХ по значению Rf, которое должно соответствовать стандартному образцу по расположению и значению. Количественное определение выполняют методом УФ-спектрофотометрии.
Хранят дилтиазема гидрохлорид по списку Б в сухом, защищенном от света месте, в плотно укупоренной таре при температуре 15-25°C.
Он является антагонистом ионов кальция, обладает гипотензивным, коронарорасширяющим и антиаритмическим действием. Назначают при различных формах стенокардии, гипертонии, аритмии, ишемической болезни сердца внутрь в виде таблеток по 0,03 или 0,06 г или капсул по 0,09 или 0,12 г.
ГЛАВА 72.
КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ b-ЛАКТАМИДОВ ТИАЗОЛИДИНА И ДИГИДРОТИАЗИНА (ПЕНИЦИЛЛИНЫ И ЦЕФАЛОСПОРИНЫ)
Общая характеристика
b-Лактамные антибиотики (b-лактамиды) содержат в молекуле лактамный цикл. Среди них различают моноциклические и бициклические b-лактамные антибиотики. К числу моноциклических b-лактамидов относятся природные антибиотики нокардицины и монобактамы, а также синтетические азетидиноны, в т.ч. моносульфактамы. К бициклическим относятся соединения, в которых четырехчленный лактамный цикл сконденсирован с другим циклом по атому азота и соседнему с ним атому углерода. Вторым циклом в системе является пятичленный тиазолидиновый (пенамы), пирролидиновый (карбопенамы) или оксазолидиновый (оксапенамы) цикл, либо шестичленный дигидротиазиновый цикл (цефалоспорины и цефамицины).
К бициклическим b-лактамидам относятся пенициллины (I) и сходные с ними по химической структуре цефалоспорины (II):

Механизм антибактериального действия b-лактамидов состоит в блокировании конечной стадии образования стенки бактерий, которое вызывает лизис клетки. Под влиянием ферментов — лактамаз происходит процесс инактивации антибиотиков. Действие этих ингибиторов основано на конкурентном антагонизме с пенициллинами, поскольку и те и другие содержат b-лактамное ядро.
При окислении атома серы тиазолидинового цикла у производных пенициллановой кислоты образуются соединения, способные подавлять b-лактамазы. Примером могут служить производные 1,1-диоксида пенициллановой кислоты (III):
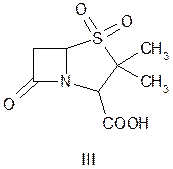
Широким спектром антимикробного действия и способностью ингибировать b-лактамазы обладают карбапенамы (IV), продуцируемые микроорганизмами рода Streptomyces. Из оксипенамов слабой антимикробной активностью, но активной способностью подавлять многие b-лактамазы обладает клавулановая кислота (V), продуцируемая Streptomyces clavuligerus.

Пенициллины
Структурной основой лекарственных веществ природных и полусинтетических пенициллинов является 6-аминопенициллановая кислота, которая включает конденсированные тиазолидиновый (A) и лактамный (B) циклы:

Лактамный цикл впервые обнаружен в природных пенициллинах и отличается большой лабильностью к воздействию различных факторов.
Специфичность биологической активности пенициллинов прежде всего обусловлена наличием в молекуле тиазолидинового и b-лактамного циклов. Расщепление одного из них приводит к полной потере активности. Важная роль в сохранении антибактериальной активности принадлежит также пространственной конфигурации молекул пенициллинов. Характер группировок, присоединенных к гетероциклической системе в положениях 2 и 3, не оказывает заметного влияния на биологическую активность. Различную химическую структуру может иметь радикал, замещающий атом водорода в аминогруппе, которая присоединена к лактамному циклу в положении 6. Это позволило получить ряд высокоактивных полусинтетических аналогов более устойчивых, чем природный пенициллин.
Пенициллин получают путем микробиологического синтеза. Отобранные для этой цели в результате селекции промышленные штаммы плесени выделяют более 3 мг/мл бензилпенициллина за 90–120 ч ферментации, что в сотни раз больше, чем удавалось получать пенициллина из природных штаммов. В состав питательной среды обычно входит 1–4% кукурузного экстракта, 3–5% лактозы, 1–2% глюкозы, 0,2–0,5% животного или растительного жира, небольшие количества минеральных солей. Обязательным компонентом является предшественник, химическая структура которого сходна с соответствующим данному антибиотику радикалу в положении 6. В частности, при производстве бензилпенициллина предшественником служит фенилуксусная кислота или ее производные; для биосинтеза феноксиметилпенициллина — феноксиуксусная кислота и т.д.
Исследование биосинтеза пенициллина с помощью меченых соединений позволило установить, что формирование молекулы осуществляется за счет содержащихся в питательной среде аминокислот (цистеина, валина) и соответствующих предшественников. Схема биосинтеза молекулы бензилпенициллина заключается в следующем:

Процесс биосинтеза пенициллинов происходит в асептических условиях при непрерывной аэрации воздухом, температуре около 24°C, рH 6,0–6,5 и должен сопровождаться постоянным перемешиванием. Наличие жира в питательной среде оказывает пеногасящее действие и одновременно стимулирует процесс биосинтеза пенициллинов.
Выделение пенициллина из культуральной жидкости осуществляют фильтрованием или центрифугированием. Вначале мицелий и нерастворимые минеральные соли отделяют от культуральной жидкости. Очистку культуральной жидкости и выделение из нее пенициллина последовательно проводят способом замены растворителя (табл. 72.1).
72.1. Схема очистки способом замены растворителя
| Растворитель | рH | Форма пенициллина |
| Культуральная жидкость (растворитель — вода) | 6,0–6,5 | Пенициллин-кислота и балластные вещества |
| Амилацетат или бутилацетат | 6,0–6,5 | Экстракт пенициллина-кислоты и балластные вещества |
| Буферный раствор (гидрокарбоната натрия) | 7,0 | Водный раствор натриевой соли пенициллина с примесью балластных веществ |
| Хлороформ и раствор хлороводородной кислоты | 2,0 | Экстракт пенициллина-кислоты |
| Буферный раствор (гидрокарбоната натрия) | 7,0 | Водный раствор натриевой соли пенициллина, свободный от балластных веществ |
Отделяют пенициллины друг от друга различными способами: адсорбционной хроматографией (на активированном угле или оксиде алюминия); распределительной хроматографией (на силикагеле) или противоточным распределением. Воду из растворов удаляют при температуре от –20 до –30°C и глубоком вакууме (лиофильная сушка) или пользуясь распылительной сушилкой, что позволяет предотвратить разложение. Кристаллические соли высокой степени чистоты получают перекристаллизацией из органических растворителей.
Особенно широко для очистки пенициллинов применяют ионообменную сорбцию. Суть метода состоит в том, что водные растворы антибиотиков пропускают через колонки с ионообменными смолами (катионитами или анионитами). В зависимости от химических свойств антибиотика и вида ионита на нем будут сорбироваться либо антибиотик, либо содержащиеся в растворе примеси. Подбирая соответствующие условия сорбции, достигают высокой степени очистки.
Применяемые в настоящее время природные пенициллины продуцируют Penicillium chrysogenum, P. notatum или родственные микроорганизмы. Этими же микроорганизмами продуцируется феноксиметилпенициллин, представляющий собой (6R)-6(2-феноксиацетамидо)-пенициллановую кислоту.
Пенициллины за счет наличия в молекуле карбоксильной группы являются кислотами, представляющими собой кристаллические вещества, очень гигроскопичные и легко инактивирующиеся. Инактивация происходит под действием кислот, щелочей и других факторов вследствие гидролиза очень лабильного b-лактамного цикла с потерей биологической активности в результате образования неактивной пенициллоиновой кислоты:

Природный бензилпенициллин применяют в виде натриевой, калиевой и других солей. Созданные на его основе многочисленные лекарственные формы отличаются наиболее высокой химиотерапевтической эффективностью и наименьшей токсичностью. Однако b-лактамный цикл бензилпенициллина легко разрушается под действием фермента пенициллиназы (b-лактамазы), продуцируемой многими микроорганизмами. Кроме того, многолетнее его применение привело к широкому распространению резистентных микробов. Эти обстоятельства послужили предпосылкой создания полусинтетических пенициллинов.
Решение такой сложной проблемы стало возможным после выделения в 1957 г. 6-аминопенициллановой кислоты (6-АПК), являющейся «ядром» пенициллина. Получают 6-АПК из бензилпенициллина (или других пенициллинов), воздействуя ферментом пенициллинацилазой, продуцируемым бактериями. Реже используют химические методы расщепления пенициллинов до 6-АПК. Процесс происходит по схеме:

Извлекают 6-АПК из водного гидролизата экстракцией или с помощью ионообменной хроматографии.
Таким образом, первая стадия производства полусинтетических пенициллинов состоит из биосинтеза 6-АПК. На второй стадии осуществляется ацилирование амина в молекуле 6-АПК соответствующей кислотой или ее хлорангидридом.
На основе 6-АПК синтезировано большое количество (более 20 тысяч) полусинтетических пенициллинов, представляющих собой ацильные производные. В качестве ацилирующих агентов используют хлорангидриды карбоновых кислот:

Биологические свойства полусинтетических пенициллинов зависят от характера заместителя в положении 6. Некоторые из синтезированных полусинтетических пенициллинов, сохраняя высокую эффективность и низкую токсичность бензилпенициллина, приобрели новые качества, например, повышение устойчивости и расширение спектра действия. Устойчивость к b-лактамазам обеспечивают заместители, создающие стерические препятствия разрыву b-лактамного цикла. Поэтому синтетические пенициллины с аминогруппой и карбоксилом в боковой цепи (в положении 6), как правило, обладают более широким спектром антибактериального действия, чем природные пенициллины. В результате разработаны и внедрены в производство такие полусинтетические пенициллины, как оксациллин, ампициллин, карбенициллин, амоксициллин, диклоксациллин, карфециллин и др.
Общая формула природных и полусинтетических пенициллинов:
В настоящее время из многочисленных известных природных пенициллинов медицинское применение имеет натриевая, калиевая, новокаиновая соли бензилпенициллина, бензатинбензилпенициллин (N,N’-дибензилэтилендиаминовая соль бензилпенициллина) и феноксиметилпенициллин. Полусинтетические пенициллины характеризуются наличием в молекуле ароматического или гетероциклического радикала. Из них наиболее широко применяют ампициллин, оксациллин, карбенициллина динатриевую соль, амоксициллин (табл. 72.2).
72.2. Химическая структура пенициллинов
| Радикал R | Пенициллин | Радикал R | Пенициллин |
| Природные | |||

| Бензилпенициллин | 
| Феноксиметилпенициллин |
| Полусинтетические | |||

| Ампициллин | 
| Оксациллин |

| Карбенициллин | 
| Амоксициллин |
По физическим свойствам природные пенициллины и их синтетические аналоги представляют собой белые или почти белые кристаллические порошки без запаха. Натриевая и калиевая соли бензилпенициллина слегка гигроскопичны. Карбенициллина динатриевая соль гигроскопична, а феноксиметилпенициллин негигроскопичен (табл. 72.3).
Натриевая и калиевая соли бензилпенициллина, натриевая соль оксациллина, динатриевая соль карбенициллина очень легко или легко растворимы в воде. Новокаиновая соль бензилпенициллина, бензатинбензилпенициллин, феноксиметилпенициллин, амоксициллин и ампициллин мало или очень мало растворимы в воде. Натриевая и калиевая соли бензилпенициллина, феноксиметилпенициллин растворимы в этиловом и метиловом спиртах, новокаиновая соль бензилпенициллина мало в них растворима. В этаноле ампициллин практически нерастворим, натриевая соль оксациллина трудно растворима, а динатриевая соль карбенициллина медленно растворима. Натриевые и калиевые соли пенициллинов, а также ампициллин, амоксициллин, бензатинбензилпенициллин практически нерастворимы в хлороформе и эфире. Феноксиметилпенициллин умеренно растворим в хлороформе, новокаиновая соль бензилпенициллина трудно в нем растворима, бензатинбензилпенициллин легко растворим в диметилформамиде. Амоксициллин нерастворим в бензоле и тетрахлорметане.
72.3. Свойства пенициллинов
| Лекарственное вещество | Химическая структура | Описание |
| Benzylpenicillin Sodium— бензилпенициллина натриевая соль | 
| Белый мелкокристаллический порошок, слегка гигроскопичен. Удельное вращение от +285 до +310° (2%-ный водный раствор) |
| Benzylpenicillin Potassium— бензилпенициллина калиевая соль | 
| Белый мелкокристаллический порошок, слегка гигроскопичен. Удельное вращение от +285 до +310° (2%-ный водный раствор) |
| Benzylpenicillin-Procaine— бензилпенициллина новокаиновая соль | 
| Белый кристаллический порошок без запаха. Удельное вращение от +165 до +180° (1%-ный раствор в смеси 3 ч ацетона и 2 ч воды) |
| Benzathine Benzylpenicillin— бензатинбензилпенициллин (Бициллин-1) |  N,N’-дибензилэтилендиаминовая соль бензилпенициллина
N,N’-дибензилэтилендиаминовая соль бензилпенициллина
| Белый порошок без запаха или почти без запаха |
| Phenoxymethylpenicillin— феноксиметилпенициллин | 
| Белый кристаллический порошок. Удельное вращение от +190 до +200° (1%-ный раствор в этаноле) |
| Ampicillin— ампициллин | 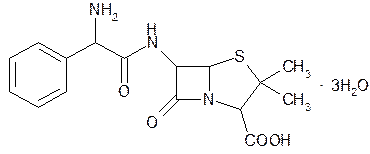 a-аминобензилпенициллин
a-аминобензилпенициллин
| Белый мелкокристаллический порошок без запаха. Удельное вращение от +280 до +305° (0,25%-ный водный раствор) |
| Oxacillin Sodium— оксациллина натриевая соль |  натриевой соли 3-фенил-5-метил-4-изоксазолилпенициллина моногидрат
натриевой соли 3-фенил-5-метил-4-изоксазолилпенициллина моногидрат
| Белый мелкокристаллический порошок. Удельное вращение от +200 до +221° (1%-ный водный раствор) |
| Carbenicillin Disodium— карбенициллина динатриевая соль |
 динатриевая соль 6-(a-карбоксифенилацетамидо) пенициллановой кислоты
динатриевая соль 6-(a-карбоксифенилацетамидо) пенициллановой кислоты
| Порошок белого или почти белого цвета. Гигроскопичен. Удельное вращение от +182 до +196° (1%-ный водный раствор) |
| Amoxicillin— амоксициллин |  a-амино-п-оксибензилпенициллин
a-амино-п-оксибензилпенициллин
| Белого или почти белого цвета кристаллический порошок. Удельное вращение от +290 до +315° (0,2%-ный водный раствор) |
Подлинность природных и синтетических пенициллинов подтверждают с помощью УФ- и ИК-спектрофотометрии. Устанавливают значения оптических плотностей растворов солей бензилпенициллина при длинах волн 280 и 263 нм, разность между которыми должна быть не менее 0,72. У феноксиметилпенициллина при 268 и 274 нм имеются максимумы поглощения, а при 272 нм — минимум, причем отношение оптических плотностей при длинах волн 268 и 274 нм должно быть в пределах 1,21–1,24. Для растворов ампициллина устанавливают значения оптических плотностей в максимумах (256, 261, 267 нм) и минимумах (255, 260, 266 нм) поглощения.
ИК-спектры природных и полусинтетических пенициллинов идентифицируют по совпадению с полосами поглощения соответствующих стандартных образцов в области 4000–400 см–1. Подлинность бензилпенициллина натриевой, калиевой, новокаиновой солей и амоксициллина устанавливают также методом ТСХ на силикагеле H или пластинках Сорбфил с последующим проявлением в парах иода.
Важная физическая константа пенициллинов — удельное вращение водных или спиртовых растворов. Все они вращают плоскость поляризованного света вправо (см. табл. 72.3).
Для установления подлинности ампициллина и бензатинбензилпенициллина, а также определения содержания в нем бензилпенициллина используют метод ВЭЖХ. Подлинность подтверждают, сравнивая время удерживания пика со стандартным образцом.
Химические реакции, используемые для испытаний подлинности пенициллинов, основаны на обнаружении в их молекулах различных функциональных групп, продуктов деструкции, атома серы, связанных аминов, катионов калия и натрия.
Для испытания подлинности пенициллинов и их полусинтетических аналогов используют цветную реакцию, основанную на разрыве b-лактамного цикла с образованием внутрикомплексной соли меди (II) с гидроксамовой кислотой (осадок зеленого цвета) или железа (III) — красное или фиолетовое окрашивание:

Образование этих солей происходит только в определенных интервалах значений рH.
Во всех пенициллинах можно обнаружить органически связанную серу после превращения ее в сульфид-ион сплавлением с едкими щелочами. Сульфид-ион затем открывают по образованию красно-фиолетового окрашивания после добавления раствора нитропруссида натрия.
Соли бензилпенициллина испытывают на ион натрия или калия с помощью соответствующих реакций (ГФ XI, вып.1, с.161, 162). Новокаиновую соль бензилпенициллина подвергают испытанию на первичные ароматические амины (ГФ XI, вып.1, с.159), а бензатинбензилпенициллин — на N,N’-дибензилэтилендиамин. Последний извлекают эфиром и после его удаления действуют раствором дихромата калия и ледяной уксусной кислотой; образуется золотисто-желтый осадок. Извлеченный эфиром дибензилэтилендиамин можно идентифицировать по температуре плавления образующегося пикрата (214 °C).
Пенициллины отличают друг от друга по различной окраске продуктов реакции с хромотроповой кислотой в присутствии концентрированной серной кислоты. Образуются продукты реакции, имеющие желтое или желто-зеленое окрашивание.
Ампициллин, благодаря наличию в молекуле остатка фениламиноуксусной кислоты, дает положительную реакцию с нингидрином подобно аминокислотам (см), а при взаимодействии с реактивом Фелинга приобретает фиолетовое окрашивание.
Феноксиметилпенициллин отличают от других пенициллинов по отрицательной реакции с концентрированной серной кислотой. Раствор остается бесцветным и после нагревания на водяной бане. Реактив Марки (раствор формальдегида в концентрированной серной кислоте) используют для идентификации феноксиметилпенициллина. Наличие в его молекуле феноксиуксусной кислоты обусловливает реакцию гидролиза до фенола и гликолевой кислоты:

Затем за счет взаимодействия фенола с реактивом Марки происходит образование ауринового красителя, имеющего красное окрашивание. При нагревании на водяной бане наблюдается усиление интенсивности окраски. Другие пенициллины не образуют окрашенных продуктов при комнатной температуре, а при нагревании на водяной бане приобретают желтое или оранжево-желтое (ампициллин), темно-желтое (амоксициллин), красно-коричневое окрашивание (соли бензилпенициллина, бензатинбензилпенициллин).
Соли бензилпенициллина дают положительную реакцию Витали–Морена подобно производным тропана (см). При выпаривании их с дымящей азотной кислой и последующем прибавлении спиртового раствора гидроксида калия и ацетона появляется фиолетовое окрашивание. Если к раствору калиевой или натриевой соли бензилпенициллина прибавлять по каплям 25%-ный раствор хлороводородной кислоты, то в осадок выпадает свободный бензилпенициллин, растворимый в избытке хлороводородной кислоты, а также в этаноле, хлороформе, эфире. Соли бензилпенициллина при кипячении в 4%-ном растворе гидроксида натрия гидролизуются с образованием натриевой соли фенилуксусной кислоты, которая после добавления избытка разбавленной серной кислоты обнаруживается по характерному запаху.
Для идентификации и фотоколориметрического определения солей бензилпенициллина, феноксиметилпенициллина, натриевой соли оксациллина используют реакцию, основанную на образовании полиметиновых красителей. Бензилпенициллин подвергают кислотному гидролизу до бензилпеницилленовой кислоты. Она вступает в реакцию сочетания с производным глютаконового альдегида, который образуется (рH 4,9) в результате расщепления пиридинового цикла под действием тиоцианата хлора.
В МФ описаны способы установления подлинности пенициллинов, основанные на использовании в качестве реактива пенициллиназы. Последняя, например у бензилпенициллина новокаиновой соли вызывает изменение окраски раствора нейтрального красного.
Ряд испытаний выполняют для установления степени чистоты природных и синтетических пенициллинов. По величине оптической плотности растворов определяют светопоглощающие примеси. Выбор длины волны и допустимые значения оптической плотности зависят от химической структуры испытуемого пенициллина. В некоторых пенициллинах устанавливают допустимое ФС содержание иодсорбирующих примесей (0,5-6%) методом обратного иодометрического определения в фосфатном или ацетатном буфере.
Природные и синтетические пенициллины испытывают на наличие воды (по методу К. Фишера) и устанавливают рH растворов или водных суспензий (потенциометрически). В соответствии с требованиями ФС пенициллины и их полусинтетические аналоги подвергают испытаниям на прозрачность и цветность растворов, микробиологическую чистоту, токсичность, пирогенность, стерильность (ГФ XI, вып.2, с.182, 183, 187).
Методом ГЖХ в пенициллинах определяют содержание остаточных растворителей (ацетона, метиленхлорида, изопропилового спирта, н-пропанола, изоамилацетата), которые используются в процессе получения и очистки. Такие испытания предусматривают ФС на бензатинбензилпенициллин, амоксициллин, ампициллин и оксациллина натриевую соль. В ампициллине тем же методом определяют примеси триметиламина (до 0,05%) и диметиланилина (до 0,002%). В бензилпенициллина новокаиновой соли и карбенициллина динатриевой соли методом ВЭЖХ определяют содержание бензилпенициллина натриевой соли, а в феноксиметилпенициллине тем же методом — содержание примеси феноксиуксусной кислоты (до 0,5%). Метод ВЭЖХ используют также для количественного определения амоксициллина по стандартному образцу с использованием в качестве подвижной фазы ацетонитрила и спектрофотометрического детектора (230 нм).
Количественное определение пенициллинов выполняют химическими методами. В некоторых из них (натриевой, калиевой, новокаиновой солях бензилпенициллина, феноксиметилпенициллине и амоксициллине) сумму пенициллинов определяют иодометрическим методом. Сущность способа заключается в том, что продукт инактивации пенициллина (1 М раствором гидроксида натрия при комнатной температуре) — натриевую соль пенициллоиновой кислоты — окисляют иодом. Процесс окисления необходимо проводить при рH 4,5 (ацетатный буфер).
Схема инактивации и окисления на примере бензилпенициллина:

Определение суммы пенициллинов выполняют обратным иодометрическим методом. Избыток 0,01 М раствора иода оттитровывают раствором тиосульфата натрия той же концентрации после 20 мин пребывания ее в темном месте (индикатор крахмал). Одновременно проводят контрольный опыт с тем же количеством пенициллина, не подвергнутого щелочному гидролизу, а также иодометрическое определение соответствующего ГСО.
Количественное определение натриевой, калиевой и новокаиновой солей бензилпенициллина выполняют гравиметрическим методом. Бензилпенициллин извлекают амилацетатом и количественно осаждают в виде N-этилпиперидиновой соли:
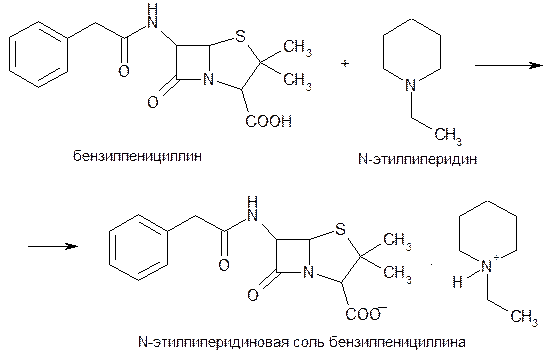
Осадок N-этилпиперидиновой соли бензилпенициллина промывают, высушивают до постоянной массы и взвешивают. Затем делают пересчет на соответствующую соль.
В новокаиновой соли бензилпенициллина определяют содержание новокаина (прокаина) спектрофотометрическим методом в водно-метанольном растворе при длине волны 290 нм. Содержание новокаина (прокаина) должно быть не менее 39 и не более 42%. Определение (по МФ) можно выполнить нейтрализацией извлеченного хлороформом основания прокаина 0,1 М раствором серной кислоты.
В бензатинбензилпенициллине определяют содержание N,N’-дибензилэтилендиамина. Его предварительно количественно извлекают эфиром, эфир отгоняют до сухого остатка, который растворяют в ледяной уксусной кислоте и титруют 0,1 М раствором хлорной кислоты (индикатор кристаллический фиолетовый или 1-нафтолбензеин).
Сумму полусинтетических пенициллинов в натриевой соли оксациллина и динатриевой соли карбенициллина определяют методом обратной нейтрализации. В его основе лежит количественно происходящий при нагревании на водяной бане процесс гидролиза 0,1 М раствором гидроксида натрия до образования производных пенициллоиновой кислоты:

Избыток гидроксида натрия оттитровывают 0,1 М раствором хлороводородной кислоты (индикатор фенолфталеин).
Ампициллин количественно определяют методом формольного титрования, подобно аминокислотам (см). Навеску растворяют в воде, добавляют разбавленный нейтрализованный раствор формальдегида и через 2 мин титруют раствором гидроксида натрия (индикатор фенолфталеин).

Известен меркуриметрический метод определения ампициллина с использованием в качестве титранта нитрата ртути (II) или хлорида ртути (II). Меркуриметрический метод (с потенциометрическим окончанием) рекомендован НД для количественного определения амоксициллина, содержание которого рассчитывают по разнице между общим количеством пенициллинов и содержанием продуктов разложения. Сумму пенициллинов определяют после щелочного гидролиза амоксициллина до образования производных пенициллоиновой кислоты.
Активность пенициллинов устанавливают микробиологическим методом по антибактериальному действию на определенный штамм золотистого стафилококка. Одна единица действия соответствует активности 0,5988 мкг химически чистой натриевой соли бензилпенициллина (1670 ЕД в 1 мг). Микробиологический метод определения пенициллинов дает воспроизводимость результатов 5–10%. Этот метод приведен в ряде ФС как альтернативный вместе с химическим или спектрофотометрическим методом. Алкалиметрический метод определения суммы пенициллинов имеет удовлетворительную воспроизводимость, но дает завышенные результаты, так как одновременно титруются все примеси, взаимодействующие со щелочью.
Наиболее точные, сопоставимые с микробиологическим методом результаты дает спектрофотометрическое определение пенициллинов, основанное на их гидролизе до пеницилленовых кислот. Они имеют максимум светопоглощения при 320-324 или 335 нм. Присутствие ионов меди (II) повышает чувствительность реакции и воспроизводимость результатов определения. Этот способ определения рекомендован для количественной оценки полусинтетических пенициллинов: ампициллина, оксациллина, карбенициллина, диклоксациллина и др. Общая схема гидролиза пенициллинов в кислой среде с образованием пеницилленовых кислот может быть представлена следующим образом:

Феноксиметилпенициллин определяют спектрофотометрическим методом при длине волны 268 нм, используя в качестве растворителя раствор гидроксида натрия (4 мл 0,1 моль/л раствора на 500 мл воды). Параллельно — в тех же условиях определяют ГСО феноксиметилпенициллина.
Для определения бензилпенициллина натриевой и калиевой соли, феноксиметилпенициллина, ампициллина и его натриевой соли МФ также рекомендовано спектрофотометрическое определение. Оно основано на взаимодействии раствора указанных пенициллинов при нагревании на водяной бане с имидазолом и хлоридом ртути (II). Светопоглощение полученного раствора измеряют при 325 нм относительно смеси реактивов. Фотоколориметрические методы определения природных пенициллинов основаны на реакциях образования окрашенных гидроксаматов железа или меди.
Пенициллины хранят по списку Б, в сухом месте, при комнатной температуре. Упаковывают соли бензилпенициллина во флаконы, герметически закрытые резиновыми пробками, обжатыми алюминиевыми колпачками. На воздухе, при повышении температуры, в присутствии влаги, тяжелых металлов они быстро разлагаются. Калиевая и натриевая соли бензилпенициллина содержат в каждом флаконе по 125 000, 250 000, 500 000 и 1 000 000 ЕД; новокаиновая соль бензилпенициллина и бензатинбензилпенициллин — по 300 000, 600 000, 1 200 000 ЕД. Ампициллин хранят в банках оранжевого стекла вместимостью по 0,5 кг, а феноксиметилпенициллин, амоксициллин и оксациллина натриевую соль — в стеклянных банках или полиэтиленовых пакетах. Карбенициллина динатриевую соль хранят при температуре не выше +5°C, бензатинбензилпенициллин — не выше +10°C, амоксициллин — при комнатной температуре, предохраняя от действия света.
Природные пенициллины применяют для лечения пневмонии, гонореи, сифилиса, раневых и гнойных инфекций, перитонита, дифтерии, скарлатины, ангин различной этиологии и инфекционных заболеваний, вызванных чувствительными к пенициллину микроорганизмами. Полусинтетические аналоги имеют более широкий спектр антибактериального действия.
Лекарственные препараты пенициллинов отличаются друг от друга по продолжительности действия и по эффективности при различных путях введения. Натриевую и калиевую соли бензилпенициллина вводят главным образом внутримышечно и подкожно по 200 000–1 500 000 ЕД в сутки в 3–6 приемов. Новокаиновая соль бензилпенициллина при внутримышечном введении обеспечивает пролонгированное действие в течение 12–18 ч, а бензатинбензилпенициллин — 1-2 недели. Устойчивость феноксиметилпенициллина, ампициллина, оксациллина и амоксициллина в кислой среде желудочного сока позволяет применять их перорально. Феноксиметилпенициллин назначают внутрь по 0,2 г, ампициллин — по 0,25–0,5 г 4–6 раз в сутки, амоксициллин по 0,5-1,0 г 3 раза в сутки. Оксациллина натриевую соль вводят внутрь по 0,25–0,5 г (суточная доза 3,0 г) или внутримышечно до 2,0–4,0 г в сутки. Карбенициллина динатриевую соль вводят внутримышечно по 4,0–8,0 г, а внутривенно (капельно) до 20–30 г в сутки.
Цефалоспорины
Цефалоспорины — один из наиболее обширных и широко применяемых классов антибиотиков. Они сходны по химической структуре с пенициллинами. Пенициллины представляют собой производные 6-аминопенициллановой кислоты (6-АПК), а цефалоспорины — 7-аминоцефалоспорановой кислоты (7-АЦК) и 7-аминодезацетоксицефалоспорановой кислоты (7-АДЦК):

Биосинтез цефалоспоринов и пенициллинов, механизм их антибактериального действия сходны между собой.
Структурную основу цефалоспоринов составляет конденсированная система, включающая дигидротиазиновый и b-лактамный циклы:

Синтезировано большое число полусинтетических цефалоспоринов, полученных в результате модификаций радикалов в положениях 3 и 7. Некоторые из них приведены в табл. 62.4. Предполагают, что антибиотическая активность цефалоспоринов обусловлена наличием b-лактамного цикла, индуктивным эффектом ацильного заместителя и стерическим эффектом молекулы.
Источник получения полусинтетических цефалоспоринов — природный цефалоспорин C. Цефалоспорин C выделен в 1945 г. из продуктов жизнедеятельности плесневого гриба Cephalosрorium salmosynnematum. Учитывая сравнительно невысокую активность цефалоспорин C применения не нашел, но он представляет интерес как источник получения 7-АЦК на основе внутримолекулярного аминолиза:

В отличие от 6-аминопенициллановой кислоты 7-аминоцефалоспорановая кислота не может быть получена ферментативным путем. Однако она является источником получения полусинтетических цефалоспоринов, например, цефалотина:

По аналогичной схеме получают цефотаксим и др. производные 7-АЦК.
Получить 7-АДЦК можно химической трансформацией пенициллинов:

Цефалотин является исходным продуктом синтеза как производных 7-АЦК, так и 7-АЦДК, в частности, цефаклора, цефалоридина и др. Сведения о химической структуре некоторых антибиотиков группы цефалоспоринов приведены в табл. 72.4.
72.4. Химическая структура цефалоспоринов
| Производные 7-АДЦК | Производные 7-АЦК | ||||
| Лек.в-во | Радикалы | Лек. в-во | Радикалы | ||
| R1 | R2 | R1 | R2 | ||
| Цефалексин | 
| H | Цефалотин | 
| 
|
| Цефалоридин | 
| 
| Цефапирин | 
| 
|
| Цефазолин | 
| 
| Цефуроксим | 
| 
|
| Цефтриаксон | 
| 
| Цефотаксим | 
| 
|
В зависимости от особенностей антибактериального действия и степени активности полусинтетические цефалоспорины делят на 4 «поколения»: первое поколение включает цефалексин, цефазолин, цефалотин, цефапирин и др., эффективные в отношении грамположительных бактерий; второе поколение включает цефаклор, цефметазол, цефамандол, цефуроксим, цефокситин, цефамицид, активно действующие на грамотрицательные бактерии (кишечная палочка, протей); к третьему поколению относят цефиксим, цефоперазон, цефотаксим, цефтриаксон, цефтибутен, цефтазидим, обладающие широким спектром действия, в т.ч. против грамотрицательных бактерий и микроорганизмов, продуцирующих b-лактамазы (пенициллиназы, цефалоспориназы). Созданные в последние годы цефалоспорины четвертого поколения (цефпиром, цефепим) обладают высокой эффективностью в отношении грамположительных и грамотрицательных бактерий и устойчивы к действию b-лактамаз.
Химические свойства цефалоспоринов обусловлены наличием в молекулах различных атомов и радикалов, в т.ч. карбоксильной группы, поэтому они могут образовывать соли, в виде которых некоторые из них применяют в медицинской практике.
В медицинской практике применяют все указанные цефалоспорины, в т.ч. отечественного производства: цефалексин и цефалотина натриевую соль (табл. 72.5).
По физическим свойствам они представляют собой белые порошки, практически нерастворимые в хлороформе и эфире. Цефалотина натриевая соль легко растворима в воде, мало и медленно растворима в этаноле, цефалексин мало растворим в воде и практически нерастворим в этаноле. Оба они являются оптически активными веществами (табл. 72.5).
72.5. Свойства цефалоспоринов
| Лекарственное вещество | Химическая структура | Описание |
| Cefalexin— цефалексин |  7-(D,a-аминофенилацетамидо)-3-метил-3-цефем-4-карбоновой кислоты моногидрат
7-(D,a-аминофенилацетамидо)-3-метил-3-цефем-4-карбоновой кислоты моногидрат
| Белый или белый со слегка желтоватым оттенком порошок, с характерным запахом. Удельное вращение от +149 до +158° (0,5%-ный раствор в буферном растворе с рH 4,4) |
| Cefalotin Sodium— цефалотина натриевая соль |  натриевая соль (7R)-7-(тиенилацетамидо) цефалоспорановой кислоты натриевая соль (7R)-7-(тиенилацетамидо) цефалоспорановой кислоты
| Белый или почти белый кристаллический порошок. Чувствителен к действию света. Удельное вращение от +124 до +134° (5%-ный водный раствор) |
Наличие сопряженных двойных связей в молекулах цефалоспоринов обусловливает характерную полосу поглощения в УФ-спектрах с максимумом поглощения в области 260 нм. У цефалексина кроме этого имеется еще один хромофор — фенильный радикал. Для испытания подлинности цефалотина натриевой соли устанавливают наличие в УФ-спектре водного раствора максимума поглощения при 237 нм, а также «плеча» при 265 нм, наличие которого связано с циклической системой 7-аминоцефалоспорановой кислоты. Методом УФ-спектрофотометрии устанавливают наличие светопоглощающих примесей. Согласно требованиям ФС 0,002%-ный раствор цефалотина натриевой соли при длине волны 237 нм в кювете с рабочей длиной 10 мм должен иметь оптическую плотность не менее 0,65 и не более 0,72 (раствор сравнения вода), а водный 0,05%-ный раствор цефалексина при длине волны 330 нм — не более 0,05.
Объективное заключение о подлинности цефалоспориновых антибиотиков позволяют сделать ИК-спектры в области 4000–400 см–1 (это испытание предусмотрено ФС). С помощью ИК-спектров можно установить наличие или отсутствие ацетоксигруппы в боковой цепи по C3 дигидротиазинового цикла и подтвердить отнесение испытуемого лекарственного вещества к числу производных 7-АДЦК (цефалексин, цефалоридин, цефазолин, цефтриаксон) или 7-АЦК (цефалотин, цефапирин, цефотаксим, цефуроксим). Для всех цефалоспоринов общими являются полосы в области колебаний карбонильных групп (1800–1500 см–1) и карбоксильной группы (1620–1600 см–1). В другой области более высоких частот (3500–2500 см–1), обусловленной валентными колебаниями амино- и амидогрупп, ИК-спектры имеют существенные различия. Наиболее специфические спектральные кривые цефалоспориновых антибиотиков расположены в области «отпечатков пальцев» (1500–650 см–1).
Для подтверждения подлинности цефалексина и цефалотина натриевой соли используют также метод ВЭЖХ на приборе с ультрафиолетовым детектором. Идентификацию проводят по временам удерживания основных пиков стандартных образцов лекарственных веществ. Перспективным для идентификации оказался метод спектроскопии ЯМР 1Н с использованием в качестве растворителя диметилсульфоксида. Выделены сигналы протонов b-лактамных и дигидротиазиновых циклов, по которым проведено отнесение анализируемых соединений к цефалоспориновым антибиотикам. Кроме того, метод позволяет по характерным сигналам протонов ацильных остатков в боковой цепи b-лактамного фрагмента и радикалов в положении 3 дигидротиазинового цикла провести надежную идентификацию каждого из цефалоспориновых антибиотиков.
Подлинность цефалоспоринов можно установить реакциями, основанными на окислении смесью 80%-ного раствора серной кислоты и 1%-ного раствора азотной кислоты. Цефалексин приобретает желтое окрашивание, а цефалотина натриевая соль — оливково-зеленое, переходящее в красно-коричневое. Открывают также ион натрия в натриевой соли цефалотина.
Наличие b-лактамного цикла у цефалоспоринов, а у цефалотина еще и сложноэфирной группы, обусловливает протекание гидроксамовой реакции. Методика выполнения такая же, как и в случае анализа пенициллинов. Образуются окрашенные гидроксаматы меди (II) и железа (III).
Цефалексин характеризуется наличием в молекуле остатка алифатической аминокислоты, которую можно обнаружить с помощью нингидрина. Аминокислотный остаток дает возможность идентифицировать цефалексин по реакции комплексообразования с ионом меди (II) в среде уксусной кислоты. После добавления раствора гидроксида натрия в нейтральной среде появляется оливково-зеленое окрашивание.
Допустимое содержание специфических примесей (фенилглицин) устанавливают методом ВЭЖХ в цефалексине и тем же методом сумму этих примесей — в цефалотина натриевой соли. Наличие примеси N,N’-диметиланилина в цефалексине и в цефалотина натриевой соли устанавливают методом ГЖХ по сумме площадей всех пиков на хроматограмме, кроме пика основного вещества. Этим же методом определяют содержание остаточных растворителей (ацетон, этанол, метанол, этилацетат и др.). Цефалоспорины подвергают и другим испытаниям на чистоту, рассмотренным на примере пенициллинов.
Количественное определение цефалексина и цефалотина натриевой соли основано на предварительном щелочном гидролизе до образования производных цефалоспорановой кислоты (соответственно 7-АДЦК и 7-АЦК). Продукты гидролиза затем окисляют титрованным раствором иода. Химический процесс, лежащий в основе иодометрического определения цефалоспоринов, сходен с химизмом инактивации и окисления пенициллинов (см).
По ФС количественное определение цефалексина выполняют спектрофотометрическим методом по собственному поглощению при длине волны 262 нм, используя в качестве растворителя и раствора сравнения воду. Расчет выполняют по стандартному образцу, светопоглощение которого измеряют в тех же условиях. Цефалотина натриевую соль по ФС определяют методом ВЭЖХ на приборе «Милихром» с колонкой, заполненной сорбентом «Силасорб C18» и ультрафиолетовым детектором при 254 нм. Расчет содержания выполняют, сравнивая площади основных пиков в испытуемом и стандартном образцах. Альтернативным является метод определения активности методом диффузии в агар с тест-микробом (ГФ XI, в.2, с.210).
Цефалексин проявляет в растворах амфотерные свойства, обусловленные наличием в молекуле карбоксильной и алифатической аминогрупп. Поэтому количественное определение может быть выполнено методом неводного титрования с использованием в качестве растворителей муравьиной и ледяной уксусной кислот в смеси с ацетоном. Это приводит к усилению основных свойств цефалексина и его оттитровывают диоксановым раствором хлорной кислоты:

Точку эквивалентности устанавливают потенциометрическим методом.
Описана методика фотометрического определения цефалексина и других цефалоспоринов, основанная на образовании окрашенных комплексов с ионом меди (II) и измерении светопоглощения при рH 6,55 в области 640–675 нм. Реактивом служит ацетат меди (II).
Цефалоспорины хранят по списку Б, в сухом защищенном от света месте при комнатной температуре.
Цефалоспорины обладают более широким, чем пенициллины, спектром антибактериального действия в отношении грамположительных и грамотрицательных кокковых микроорганизмов, спирохет, сибиреязвенных палочек. Натриевые соли цефалоспоринов применяют внутримышечно, реже внутривенно и внутриплеврально при острых и хронических заболеваниях дыхательных органов, мочевых путей, половых органов, при послеоперационных и других инфекциях. Ряд цефалоспоринов (цефалоглицин, цефалексин), в т.ч. третьего поколения (цефиксим, цефтибутен) эффективны при пероральном применении. Цефалексин выпускают в капсулах по 0,25 г. Цефалотина натриевую соль выпускают в виде порошка в герметически укупоренных флаконах по 0,5; 1,0; 2,0 г, содержимое которых растворяют в 10 мл воды для инъекций.
Ингибиторы бета-лактамаз
К этой группе относится представитель пенамов — производное 1,1-диоксида пенициллановой кислоты сульбактама натриевая соль, представляющая собой натриевую соль сульфонпенициллата (табл. 72.6).
72.6. Свойства сульбактама натриевой соли
| Лекарственное вещество | Химическая структура | Описание |
| Sulbactam-Sodium— сульбактама натриевая соль |  натриевая соль 1,1-диоксида пенициллановой кислоты
натриевая соль 1,1-диоксида пенициллановой кислоты
| Белый или почти белый кристаллический порошок. Удельное вращение от +205 до +235° (1%-ный раствор высушенного лекарственного вещества) |
Сульбактама натриевая соль — белое кристаллическое вещество, легко растворимое в воде и растворах кислот, мало растворимое в этаноле, ацетоне, этилацетате, практически нерастворимое в эфире и хлороформе.
Подлинность сульбактама натриевой соли устанавливают по иону натрия и с помощью ТСХ на стеклянной пластинке с закрепленным слоем силикагеля КСКГ. На пластинку наносят 0,5%-ные растворы испытуемого и стандартного образца сульбактама натриевой соли. Хроматографируют, используя систему растворителей: бутилацетат-бутиловый спирт-кислота уксусная-фосфатный буфер с pH 6,0 (50:9:25:15). Проявляют высушенную хроматограмму парами иода. Основное пятно по своему положению должно соответствовать пятну стандартного образца.
Допустимое содержание специфических примесей (не более 3,5%) устанавливают методом ВЭЖХ с ультрафиолетовым детектором при 214 нм по сумме площадей всех пиков (кроме пика основного вещества) на одной хроматограмме. Устанавливают также прозрачность, цветность, pH (5,0-7,0) 5%-ного раствора сульбактама натриевой соли, его токсичность и пирогенность. Воду (не более 1%) определяют методом К. Фишера.
Количественное определение выполняют методом УФ-спектрофотометрии при длине волны 260 нм. В качестве раствора сравнения используют боратный буферный раствор, в котором растворяют навеску испытуемого вещества и стандартного образца.
Фармакопея США рекомендует количественно определять содержание сульбактама натриевой соли методом ВЭЖХ, используя подвижную фазу, состоящую из 0,005 М раствора тетрабутиламмония гидроксида в ацетонитриле. Измерение оптической плотности выполняют с помощью УФ-детектора при длине волны 230 нм, сравнивая со стандартным образцом сульбактама натриевой соли.
Хранят сульбактама натриевую соль по списку Б, в сухом, защищенном от света месте, при комнатной температуре.
Наряду с сульбактама натриевой солью ингибитором b-лактамаз является кислота клавулановая. Они сходны по химической структуре:

Выпускают кислоту клавулановую в виде калиевой соли, которая включена в фармакопею США. Для ее испытаний использован метод ВЭЖХ. Подлинность подтверждают, сравнивая испытуемое вещество со стандартным образцом клавулановой кислоты. Количественное определение выполняют, используя подвижную фазу, состоящую из фосфатного буфера и метанола (95:5). Детектируют при длине волны 220 нм, используя для сравнения стандартный раствор клавуланата-лития.
Ингибиторы b-лактамаз проявляют слабо выраженную антибактериальную активность, но необратимо ингибируют b-лактамазу. При использовании в виде комбинированных лекарственных форм в сочетании с пенициллинами они защищают их от гидролиза и инактивации, т.е. повышают устойчивость к разложению.
Выпускается «потенцированная» лекарственная форма — таблетки «Клавунат», содержащие 0,25 или 0,5 г амоксициллина и 0,125 г клавулановой кислоты. Аугментин (Augmentin) содержит амоксициллин и клавуланат калия. Его выпускают в виде таблеток по 0,375 г. Уназин (Unasyn) — комбинированный лекарственный препарат, содержащий ампициллин-натрий и сульбактам-натрий в соотношении 2:1. Его применяют внутримышечно и внутривенно аналогично ампициллину.
ГЛАВА 73.
|
Просмотров 8078 |
|
|
