
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Общая характеристика лекарственных веществ, производных пурина
|
|
Пурин — конденсированная гетероциклическая система, состоящая из двух циклов: пиримидина и имидазола. Эта система может образовывать два изомера: 9H-пурин и 7H-пурин:

Пуриновые алкалоиды являются производными ксантина (2,6-диоксипурина), который может существовать в виде енольной (I) и кетонной (II) 7H-формы:

На основе концепции антиметаболитов нуклеиновых кислот, содержащих в молекуле пуриновые основания, в последние годы были созданы мощные антивирусные средства, производные гуанина:

Разносторонним фармакологическим действием обладают 6,9-замещенные пурина, имеющие общую формулу:

Изостером 9H-пурина является гетероциклическая система 4H-пиразоло-[3,4-d]пиримидина:

Исследование его производных привело к созданию средств, способствующих выведению уратных конкрементов.
Производные ксантина
В медицинской практике наиболее широко применяют производные ксантина, алкалоиды кофеин, теобромин, теофиллин и их синтетические аналоги дипрофиллин и пентоксифиллин.
Они имеют общую формулу и заместители:

| Лекарственное вещество | Заместители | |
| R1 | R2 | |
| Кофеин | –CH3 | –CH3 |
| Теобромин | –CH3 | –H |
| Теофиллин | –H | –CH3 |
| Дипрофиллин | 
| –CH3 |
| Пентоксифиллин | –CH3 | 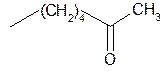
|
Кофеин открыт впервые Рунге в 1819 г. Он содержится (до 2%) в зернах кофе (Coffea arabica L.), семейство мареновых — Rubiaceae, листьях чая (Thea sinensis L.), семейство чайных — Theaceae и в других растениях. В небольших количествах в чае содержится теофиллин, который был открыт Косселем в 1889 г. Теобромин впервые изучен русским ученым А.А.Воскресенским в 1842 г, а в 1889 г был выделен из зерен кофе и чайных листьев.
Природным источником получения пуриновых алкалоидов служат отходы чайной промышленности (чайная пыль, обрезки листьев и т.д.), содержащие 1–3% кофеина; бобы какао, в которых находится 1,5–2% теобромина.
Известно несколько способов получения кофеина. Один из них основан на противоточной экстракции. Водный экстракт очищают от примесей, осаждают балластные вещества с помощью солей свинца, кальция, магния. Фильтрат затем выпаривают. Перекристаллизацию кофеина производят из охлажденных водных растворов. Аналогичным способом выделяют из бобов какао теобромин либо в виде основания, либо в виде кальциевой соли (растворимой в воде).
Значительно больший выход дает способ получения кофеина, разработанный в 1952 г. Н.А.Измайловым, Ю.В.Шостенко, В.Д.Безуглым. Он основан на адсорбции кофеина из водных растворов с последующей десорбцией хлороформом или дихлорэтаном.
Синтез и свойства. Синтетические способы получения пуриновых алкалоидов отличаются более высокой экономичностью и доступностью исходного сырья. Таким сырьем является мочевая кислота, которую предварительно синтезируют термической конденсацией двух молекул мочевины с ацеталем (110°C) или извлекают водой из экскрементов птиц (гуано), где ее количество достигает 25%. Кофеин и теобромин синтезируют после предварительного получения ксантина из мочевой кислоты действием формамида:

Ксантин затем метилируют диметилсульфатом. В зависимости от условий метилирования получают кофеин или теобромин:

Кофеин получается, если метилирование выполняют при рH 8,0–9,0, а теобромин — в присутствии гидроксида калия и метанола при 60–70° C.
Источниками получения дипрофиллина и пентоксифиллина являются природные алкалоиды теофиллин и теобромин.
Синтез дипрофиллина осуществляют путем взаимодействия натриевой соли теофиллина с a-монохлоргидрином глицерина:

Пентоксифиллин синтезируют из теобромина или ксантина:

67.1 Свойства производных ксантина
| Лекарственное вещество | Химическая структура | Описание |
| Caffeine— кофеин |  1,3,7-триметилксантин
1,3,7-триметилксантин
| Белые шелковистые игольчатые кристаллы или белый кристаллический порошок без запаха. Т. пл. 235–238° C |
| Theobromine— теобромин |  3,7-диметилксантин
3,7-диметилксантин
| Белый кристаллический порошок без запаха |
| Theoрhylline— теофиллин |  1,3-диметилксантина моногидрат
1,3-диметилксантина моногидрат
| Белый или почти белый кристаллический порошок без запаха. Т. пл. 270–274° C |
| Diprophylline— дипрофиллин |  7-(2,3-диоксипропил)-теофиллин
7-(2,3-диоксипропил)-теофиллин
| Белый мелкокристаллический порошок. Т.пл. 158–163° C |
| Pentoxiphylline— пентоксифиллин |  1-(5-оксогексил)-теобромин
1-(5-оксогексил)-теобромин
| Белый или белый со слабым желтоватым оттенком кристаллический порошок, практически без запаха. Т.пл. 103–106° C |
Производные ксантина представляют собой белые кристаллические вещества без запаха (табл. 67.1). Отличаются друг от друга по температуре плавления и растворимости. Кофеин на воздухе выветривается, при нагревании возгоняется.
Кофеин в холодной воде умеренно и медленно растворим (1:60), теофиллин мало растворим, теобромин практически нерастворим. В горячей воде кофеин и теофиллин легко растворимы, а теобромин мало растворим. Дипрофиллин медленно растворим в воде (1:10), растворим в этаноле (при кипячении), пентоксифиллин умеренно растворим в воде и этаноле. В этаноле кофеин мало растворим. Теофиллин в этаноле и в хлороформе мало растворим, а теобромин практически нерастворим. Кофеин и пентоксифиллин в отличие от теофиллина и теобромина легко растворимы в хлороформе. Дипрофиллин практически нерастворим в хлороформе и ацетоне. В эфире производные ксантина практически нерастворимы или мало растворимы. Теофиллин и теобромин растворимы в разведенных растворах кислот и щелочей. Ввиду наличия незамещенных атомов водорода в положении 1 или 7 при растворении теофиллина и теобромина в щелочах происходит образование солей.
Применяют также лекарственные препараты двойных солей пуриновых алкалоидов: кофеин-бензоат натрия, аминофиллин (эуфиллин), ксантинола никотинат (табл. 67.2).
67.2. Свойства двойных солей производных ксантина
| Лекарственное вещество | Химическая структура | Описание |
| Caffein-benzoate Sodium— кофеин-бензоат натрия | 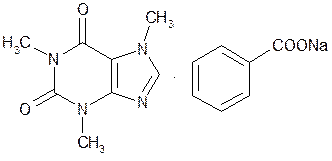
| Белый порошок без запаха |
| Aminophylline— аминофиллин (Эуфиллин) |  теофиллин с 1,2-этилендиамином
теофиллин с 1,2-этилендиамином
| Белый или белый с желтоватым оттенком кристаллический порошок со слабым аммиачным запахом |
| Xantinol Nicotinate— ксантинола никотинат |  7-[2-гидрокси-3-(N-метил-b-гидроксиэтиламино)-пропил] теофиллина никотинат 7-[2-гидрокси-3-(N-метил-b-гидроксиэтиламино)-пропил] теофиллина никотинат
| Белый кристаллический порошок без запаха. Т.пл. 180–186° C |
Получение кофеин-бензоата натрия обусловлено способностью кофеина образовывать стойкие двойные соли с солями органических кислот. Кофеин-бензоат натрия получают смешением водных растворов, содержащих 40% кофеина и 60% натрия бензоата. Затем раствор выпаривают досуха. Аналогичный способ лежит в основе получения аминофиллина (соль теофиллина с 1,2-этилендиамином), а также ксантинола никотината.
По физическим свойствам двойные соли пуриновых алкалоидов (см. табл. 57.2) — белые кристаллические порошки. Аминофиллин имеет аммиачный запах, обусловленный наличием этилендиамина. На воздухе он поглощает углекислый газ. Растворимость его при этом уменьшается. Двойные соли отличаются лучшей растворимостью в воде, чем соответствующие им алкалоиды. Кофеин-бензоат натрия и ксантинола никотинат легко растворимы, аминофиллин — растворим в воде. Водные растворы двойных солей имеют щелочную реакцию. Кофеин-бензоат натрия умеренно растворим, а аминофиллин и ксантинола никотинат очень мало растворимы в этаноле. Практически нерастворимы в эфире и хлороформе кофеин-бензоат натрия и ксантинола никотинат.
Испытание на подлинность и чистоту. Для испытания на подлинность производных ксантина используют реакции окисления, осаждения, комплексообразования. Общей реакцией, рекомендуемой для испытания подлинности производных ксантина, является мурексидная проба. Она основана на разрушении молекулы пурина при нагревании с окислителем (пероксидом водорода, бромной водой, азотной кислотой и т.д.) до образования смеси метилированных производных аллоксана и диалуровой кислоты. Взаимодействуя между собой, они образуют метилированные производные аллоксантина, которые под действием избытка раствора аммиака приобретают пурпурно-красное окрашивание. Окраска обусловлена появлением аммонийной соли тетраметилпурпуровой кислоты.
Кофеин дает мурексидную пробу по схеме

По данным некоторых авторов (А.П. Арзамасцев) появляющаяся окраска обусловлена образованием мезомерно стабилизированного аниона:
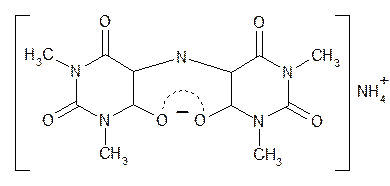
Аналогичная схема лежит в основе мурексидной пробы на теофиллин, теобромин и другие производные пурина. Пурпурно-красное окрашивание исчезает при добавлении нескольких капель гидроксида натрия.
Идентифицировать производные ксантина и двойные соли пуриновых алкалоидов можно по ИК-спектрам поглощения в области 4000-400 см–1. Этот метод ФС рекомендуют для подтверждения подлинности кофеина, теофиллина и пентоксифиллина.
Подлинность производных ксантина устанавливают УФ-спектрофотометрическим методом. УФ-спектр раствора кофеина в 0,1 М растворе хлороводородной кислоты в области 250-300 нм имеет максимум светопоглощения при 273 нм. В той же области (270-273 нм) находится максимум светопоглощения у водных растворов кофеина-бензоата натрия, теофиллина и теобромина. Водный раствор пентоксифиллина имеет максимум поглощения при 274 нм, минимум при 246 нм и плечо в интервале 226-235 нм. Раствор ксантинола никотината в 0,1 М растворе хлороводородной кислоты имеет максимум поглощения при 267 нм и плечо в интервале 262-264 нм.
Идентифицировать производные ксантина, являющиеся третичными основаниями, можно с помощью осадительных (общеалкалоидных) реактивов. Кофеин и пентоксифиллин с 0,1% раствором танина образуют белые осадки танатов, растворимые в избытке реактива. Раствор кофеина в горячей воде при добавлении 0,1 М раствора иода остается прозрачным, но при добавлении нескольких капель хлороводородной кислоты образуется бурый осадок, растворимый в избытке раствора гидроксида натрия:

Аналогичные результаты достигаются при получении периодида пентоксифиллина, теофиллин образует в этих условиях темно-коричневый осадок. Водный раствор пентоксифиллина при добавлении реактивов Зонненштейна или Шейблера образует осадки белого цвета, а с реактивом Драгендорфа — желтый осадок.
В отличие от кофеина теобромин и теофиллин обладают кислотными свойствами за счет наличия ионов водорода имидных групп в положении 1 или 7. Поэтому они образуют соли с различными катионами (кобальта, меди, ртути, серебра), что используется для идентификации. Их вначале превращают в натриевые соли, действуя раствором гидроксида натрия. В качестве реактива, позволяющего отличать друг от друга кофеин, теофиллин и теобромин, используют раствор хлорида кобальта. Теобромин образует осадок серовато-голубого цвета, который выпадает после появления быстро исчезающего фиолетового окрашивания:

Теофиллин в тех же условиях образует белый с розоватым оттенком осадок:

Подлинность теофиллина, теобромина можно также установить по образованию из растворов их натриевых солей характерных осадков солей серебра. Кофеин, не обладающий кислотными свойствами, не дает положительных реакций ни с ионом кобальта, ни с ионом серебра.
Соль теобромината серебра при нагревании на водяной бане до 60°C образует коричневую желатинообразную массу.

Серебряная соль теофиллина представляет полупрозрачный студенистый осадок, разжижающийся при нагревании и вновь застывающий при охлаждении:

Теофиллин в отличие от других пуриновых алкалоидов под действием щелочного раствора нитропруссида натрия приобретает характерное зеленое окрашивание, исчезающее после добавления избытка кислоты.
Теофиллин после щелочного гидролиза (в 30%-ном растворе гидроксида натрия при нагревании) превращается в теофиллидин, который вступает во взаимодействие с солью диазония, образуя азокраситель красного цвета:

Аналогичный азокраситель образует в тех же условиях пентоксифиллин.
Общей для кофеина, теобромина и теофиллина является реакция с хлоридом ртути (II). Образуется белый кристаллический осадок, представляющий собой комплексное соединение, включающее оба вещества в эквимолекулярном соотношении, например, у кофеина C8H10N4O2 × HgCl2. Поэтому данная реакция использована и для их косвенного комплексонометрического определения.
Дипрофиллин при кипячении с раствором гидроксида натрия выделяет аммиак, который обнаруживают по запаху или изменению окраски красной лакмусовой бумаги. При нагревании смеси порошков дипрофиллина и гидросульфата калия в пробирке, накрытой фильтровальной бумагой, смоченной раствором нитропруссида натрия и каплей пиперидина, на бумаге появляется синее пятно, которое переходит в розовое после добавления 2-3 капель 1 М раствора гидроксида натрия. Реакция основана на образовании летучих альдегидов в результате дегидратирующего действия на дипрофиллин гидросульфата калия. Окрашивание возникает при взаимодействии альдегидов с реактивом.
Пентоксифиллин идентифицируют также методом ТСХ на пластинках с силикагелем G восходящим методом в смеси растворителей: метанол-этилацетат (3:17). Проявляют хроматограмму, нагревая со смесью анисового альдегида, ледяной уксусной и серной кислот. Пятно окрашивается в желтый цвет, переходящий в темно-фиолетовый.
Пуриновое ядро в молекулах двойных солей обнаруживают с помощью мурексидной пробы. Кофеин из подщелоченного водного раствора кофеина-бензоата натрия извлекают хлороформом. Хлороформ отгоняют, остаток сушат (при 80°C) и устанавливают температуру плавления кофеина (234–237°C). Присутствие кофеина в кофеина-бензоате натрия подтверждают также положительной реакцией с иодом в присутствии хлороводородной кислоты (образование периодида). Для испытания подлинности двойных солей пуриновых алкалоидов ФС рекомендует обнаруживать ион натрия и бензоат-ион в кофеине-бензоате натрия. Этилендиамин в аминофиллине открывают с помощью раствора сульфата меди (фиолетовое окрашивание).
Подлинность аминофиллина можно установить путем осаждения теофиллина из водного раствора (полученного при нагревании) с помощью хлороводородной кислоты. Промытый и высушенный теофиллин должен иметь температуру плавления 269–274°C. Из фильтрата с помощью бензоилхлорида в щелочной среде осаждают дибензоилэтилендиамин:

Осадок отфильтровывают, промывают водой, перекристаллизовывают из этанола, промывают, сушат. Его температура плавления должна быть 250–251°C.
Наличие кислоты никотиновой в двойной соли ксантинола никотинате устанавливают методом ТСХ на пластинках Силуфол УФ-254, сравнивая со свидетелем. Пластинку с пробами испытуемого вещества и свидетеля (кислоты никотиновой) хроматографируют в системе: н-бутанол-метанол-раствор аммиака-хлороформ (8:9:6:14). Высушенную хроматограмму просматривают в УФ-свете. Должно быть одно пятно ксантинола и одно пятно кислоты никотиновой.
Испытания на чистоту производных ксантина и их двойных солей выполняют, устанавливая допустимые пределы примесей посторонних алкалоидов. При испытании кофеина примеси других алкалоидов обнаруживают с помощью реактива Майера, который не дает положительной реакции с самим кофеином. В теофиллине регламентируется содержание примесей других пуриновых оснований, а в теобромине — примеси кофеина. Обнаружение указанных примесей в теофиллине и теобромине обусловлено некоторым различием кислотных свойств, так как рKa теобромина и теофиллина соответственно равны 9,9 и 8,8. Благодаря этому теофиллин в отличие от теобромина растворяется в растворе аммиака.
Наряду с использованием указанных химических свойств, основным методом, применяемым для обнаружения посторонних примесей, в т.ч. иных пуриновых алкалоидов в производных ксантина является ТСХ. Испытания выполняют на пластинках Силуфол УФ-254 или пластинках, покрытых слоем силикагеля F254. Хроматографируют восходящим методом в системах растворителей различного состава. Детектируют, как правило, в УФ-свете при длине волны 254 нм и оценивают содержание примесей по величине и интенсивности пятен на хроматограммах, сравнивая их со свидетелями. Кофеин, согласно требованиям ФС, может содержать примеси теобромина и теофиллина (не более 0,5%). Суммарное содержание примесей в пентоксифиллине не должно превышать 1%, в аминофиллине — не более 0,5%. Наличие примеси теофиллина (не более 0,5%) в ксантинола никотинате устанавливают в той же системе, что и при испытании его на подлинность.
Количественное определение. Для количественного определения производных ксантина и их двойных солей используют особенности кислотно-основных свойств.
Кофеин в водных растворах проявляет очень слабые основные свойства, практически его растворы имеют нейтральную реакцию. С минеральными кислотами кофеин солей не образует (они сразу же гидролизуются). Поэтому метод нейтрализации в водных растворах для кофеина неприменим. В неводной среде (хлороформ, уксусный ангидрид, бензол) кофеин проявляет выраженные основные свойства и его можно оттитровать хлорной кислотой (индикатор кристаллический фиолетовый).
Кофеин и теобромин имеют электронодонорную метильную группу в положении 7, благодаря чему усиливается отрицательный заряд атома азота в положении 9. Кофеин кроме того имеет две метильные группы в пиримидиновом кольце. В связи с этим наблюдается увеличение отрицательных зарядов в циклах молекулы, а следовательно, у атома азота в положении 9 заряд у кофеина наибольший. Вот почему основные свойства у всех трех алкалоидов обусловлены наличием атома азота в положении 9, причем кофеин наиболее сильное основание, а теофиллин — наиболее слабое. Процесс титрования кофеина в неводной среде (смесь хлороформа и уксусного ангидрида) протекает по следующей схеме:

Пентоксифиллин определяют в смеси уксусного ангидрида и бензола (10:20) с тем же титрантом и индикатором. При количественном определении по ФС теобромина в качестве неводного растворителя используют муравьиную кислоту и уксусный ангидрид (1:10), индикатором служит раствор судана III. Ксантинола никотинат количественно определяют в смеси ледяной уксусной кислоты и уксусного ангидрида (2:18), эквивалентную точку устанавливают потенциометрически со стеклянным индикаторным электродом.
Теофиллин, теобромин обладают амфотерными свойствами. Но ни по кислотным, ни по основным свойствам их титрование в водной среде невозможно, так как эти свойства очень слабы.
Способность кофеина и теобромина образовывать периодиды в кислой среде использована для обратного иодометрического определения. Избыток титрованного раствора иода, содержащего иодид калия, осаждает из раствора кофеин в виде периодида (уравнение реакций см. выше). Иодометрическое определение используют (ФС) для количественного определения кофеина в кофеине-бензоате натрия. Титрантом служит 0,1 М раствор иода. Периодид кофеина осаждают, осадок отделяют, пропуская смесь через вату в сухую колбу. В аликвотной части фильтрата определяют избыток титранта с помощью 0,1 М раствора тиосульфата натрия (индикатор крахмал). Параллельно проводят контрольный опыт.
Для количественного определения кофеина в смесях используют гравиметрический метод, основанный на его извлечении с помощью хлороформа.
Бензоат натрия в кофеине-бензоате натрия определяют нейтрализацией 0,5 М раствором хлороводородной кислоты в присутствии смешанного индикатора (растворы метилового оранжевого и метиленового синего в соотношении 1 : 1):

Для извлечения выделяющейся бензойной кислоты определение проводят в присутствии эфира. Кофеин-бензоат натрия должен содержать 38–40% кофеина и 58–62% бензоата натрия.
Кофеин, теобромин и теофиллин можно количественно определить цериметрическим методом. Избыток сульфата церия, используемого в качестве титранта, при нагревании окисляет их в кислой среде до образования аллоксанов (1,3-диметилаллоксан образуется при окислении кофеина, 3-метилаллоксан — при окислении теобромина). На примере кофеина процесс можно представить следующим образом:

Избыток сульфата церия устанавливают иодометрическим методом после добавления 10%-ного раствора иодида калия и хлороформа. В качестве титранта используют тиосульфат натрия.
Для количественного определения теобромина и теофиллина используют сочетание аргентометрии и кислотно-основного титрования (метод косвенной нейтрализации). Метод основан на образовании солей серебра и выделении эквивалентного количества азотной кислоты. Ее титруют 0,1 М раствором гидроксида натрия (индикатор феноловый красный):
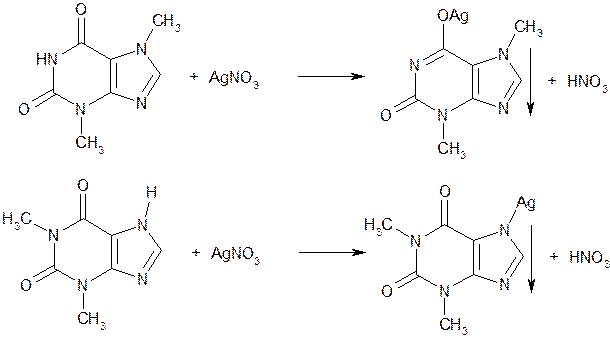
HNO3 + NaOH ¾® NaNO3 + H2O
Известны различные варианты такого определения. Один из них (прямой) основан на потенциометрическом титровании выделившейся кислоты, другой (обратный) — на определении избытка титрованного раствора нитрата серебра по Фольгарду.
С целью исключения расхода нитрата серебра разработан способ количественного определения теофиллина, основанный на его взаимодействии с нитратом кадмия. Электронное строение катионов кадмия и серебра сходно. В результате реакции одна молекула нитрата кадмия взаимодействует с двумя молекулами теофиллина, замещая атом водорода в положении 7 имидазольного цикла. Происходит выделение двух молекул азотной кислоты, которую оттитровывают 0,1 М раствором гидроксида натрия (индикатор феноловый красный). Образующийся вблизи точки эквивалентности белый осадок не мешает титрованию.
Количественное определение теофиллина в аминофиллине выполняют после нагревания (для удаления этилендиамина) в течение 2,5 ч при 125–130°C, используя метод косвенной нейтрализации. Этилендиамин в отдельной навеске титруют 0,1 М раствором хлороводородной кислоты в присутствии индикатора метилового оранжевого:

Аминофиллин должен содержать 80–85% теофиллина и 14–18% этилендиамина.
Теофиллин в аминофиллине можно определить аргентометрическим методом с использованием в качестве индикатора амидопирина. Освобождающаяся при титровании азотная кислота нейтрализуется этилендиамином и не мешает титрованию. В эквивалентной точке раствор приобретает синеватое окрашивание.
Предложен экспресс-метод определения теофиллина в аминофиллине в смеси растворителей диметилформамид — вода с помощью титранта — 0,1 М водного раствора гидроксида натрия (индикатор тимоловый синий). В этой среде кислотные свойства теофиллина усиливаются настолько, что становится возможным его титрование как кислоты. Содержание воды в точке эквивалентности достигает 20–25% и не оказывает влияния на результаты титрования.
Алкалиметрический метод определения теофиллина и аминофиллина основан на образовании натриевой соли теофиллина. В качестве растворителя используют этанол (при нагревании на водяной бане). Раствор охлаждают и титруют 0,1 М раствором гидроксида натрия (индикатор тимолфталеин). Количественное определение дипрофиллина может быть выполнено методом Кьельдаля.
Спектрофотометрическое определение кофеина и кофеина-бензоата натрия выполняют, используя в качестве растворителя воду (272 нм), теобромина и теофиллина — 0,1 М раствор гидроксида натрия (272 нм), дипрофиллин определяют — в водных растворах (273 нм). Описаны также фотоколориметрические и фототурбидиметрические методики определения пуриновых алкалоидов в лекарственных формах. Содержание теофиллина в аминофиллине определяют фотоколориметрическим методом на основе цветной реакции с нитропруссидом натрия и гексацианоферратом (III) калия. Для фотометрического определения этилендиамина в аминофиллине в качестве реактива используют нингидрин.
Хранение и применение. Производные ксантина и их двойные соли хранят по списку Б, в хорошо укупоренной таре. Теофиллин предохраняют от действия света. Учитывая способность аминофиллина поглощать углекислый газ из воздуха, его необходимо хранить в заполненной доверху таре, предохраняя от действия света и влаги. Кофеин-бензоат натрия хранят в сухом, защищенном от света месте при температуре не выше +25°C.
Кофеин и кофеин-бензоат натрия применяют внутрь по 0,05–0,1 г 2–3 раза в день в качестве стимулятора центральной нервной системы, кардиотонического средства, при спазмах сосудов. Последние исследования показали, что кофеин может предохранять организм от вредного воздействия радиации. Кофеин-бензоат натрия лучше растворим в воде, поэтому его можно использовать в виде растворов для инъекций.
Теобромин и теофиллин применяют в качестве спазмолитических (сосудорасширяющих, бронхорасширяющих) и диуретических средств. Назначают теобромин по 0,25–0,5 г, а теофиллин по 0,1–0,2 г. Аминофиллин назначают при тех же показаниях, что и теофиллин. Хорошая растворимость в воде позволяет вводить его не только внутрь (0,1–0,15 г), но и внутримышечно (12%-ные и 24%-ные растворы), а также внутривенно (2,4%-ные растворы).
Пентоксифиллин — вазодилатирующее, ангиопротекторное, антиагрегантное, антитромбическое средство. Его назначают при нарушениях периферического кровообращения, цереброваскулярной патологии, в офтальмологии и оториноларингологии в виде таблеток (драже) по 0,1 г и 2%-ных растворов в ампулах по 5 мл для инъекций.
Дипрофиллин назначают при спазмах коронарных сосудов, сердечной и бронхиальной астме, гипертонической болезни. Вводят внутрь (0,2–0,5 г 3–4 раза в день), внутримышечно (3–5 мл 10%-ного раствора), внутривенно (5–10 мл 2,5%-ного раствора). Ксантинола никотинат является средством, улучшающим периферическое и церебральное кровообращение. Он выпускается в виде таблеток «Теоникол», а также 15%-ного раствора ксантинола никотината для инъекций.
Производные гуанина
Гуанин (2-амино-6-оксипурин) содержится в экскрементах птиц, чешуе рыб и рептилий. Образуется при гидролизе нуклеиновых кислот или из 2,8-дихлоргипоксантина при действии на него аммиаком с последующим гидрированием:

Гуанин может существовать в виде двух таутомерных форм (кетонной и енольной):

Применяемые в медицинской практике противовирусные средства ацикловир и ганцикловир (табл. 67.3) имеют общую формулу:

Они очень сходны по химической структуре и отличаются только числом оксиметильных групп в алифатической цепи (R). Ганцикловир представляет собой натриевую соль.
Исходными продуктами синтеза ацикловира служат гуанин или 2,6-дихлорпурин. Их подвергают N-алкилированию 1-хлорметил-2-бензоилэтиленгликолем. Затем атомы хлора действием спиртового раствора аммиака замещают на аминогруппы, одну из которых через соль диазония превращают в гидроксигруппу. Конечной стадией является снятие бензольной защиты у этиленгликолевого заместителя:

67.3. Свойства производных гуанина
| Лекарственное вещество | Химическая структура | Описание |
| Aciclovir— ацикловир (Зовиракс) |  9-[(2-гидрокси)-этоксиметил]гуанин
9-[(2-гидрокси)-этоксиметил]гуанин
| Белый кристаллический порошок без запаха. Т.пл. 250°C (с разложением) |
| Ganciclovir— ганцикловир (Цимевен) |  9-(1,3-дигидрокси-2-пропоксиметил)гуанин натрий
9-(1,3-дигидрокси-2-пропоксиметил)гуанин натрий
| Белый или почти белый кристаллический порошок |
Ацикловир и ганцикловир — белые кристаллические вещества (табл. 67.3). Ацикловир очень мало растворим в воде и этаноле, практически нерастворим в эфире, растворим в растворах щелочей и кислот. Ганцикловир мало растворим в воде, он представляет собой полярное гидрофильное соединение — водные растворы имеют pH 11,0.
Для испытания на подлинность производных гуанина используют ИК- и УФ-спектры, которые должны соответствовать спектрам стандартных образцов. ИК-спектр ацикловира снимают после прессования в таблетках бромида калия в области 4000-400 см–1. На тонкослойной хроматограмме ацикловира пятно основного вещества должно быть на уровне пятна стандартного образца. Устанавливают подлинность также методом ВЭЖХ по (фармакопея США) времени удерживания основных компонентов ацикловира с использованием гуанина в качестве внутреннего стандарта. Подвижной фазой служит ледяная уксусная кислота и вода (1:1000).
В ацикловире методом ТСХ устанавливают наличие примеси гуанина (не более 0,7%) и других примесей (0,8%). Подвижной фазой служит система растворителей: хлороформ-метанол-раствор аммиака (78:20:2). В ганцикловире посторонние примеси определяют методом ВЭЖХ (не более 2%).
Количественное определение ацикловира и ганцикловира выполняют методом ВЭЖХ. Ацикловир хроматографируют на колонке с обращенной фазой. Подвижная фаза включает 0,01 М раствор натрия дигидрофосфата и ацетонитрил. Детектируют при длине волны 254 нм.
Хранят ацикловир по списку Б при температуре не выше 25°C, ганцикловир — при той же температуре в прохладном, защищенном от света месте. Готовые растворы хранят в холодильнике до 24 часов.
Применяют ацикловир и ганцикловир в качестве противовирусных средств. Ацикловир особенно эффективен в отношении вирусов простого и опоясывающего герпеса, ветряной оспы. Его применяют внутрь в виде таблеток по 0,2 г, внутривенно до 0,25 г в сутки, наружно — в виде 3%-ной глазной мази и 5%-ного крема для кожи. Ганцикловир назначают при инфекциях, вызванных цитомегаловирусом внутривенно (до 10 мг/кг в сутки), внутрь в капсулах по 0,25 г.
|
Просмотров 14331 |
|
|
