
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Глава 15. ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ
|
|
В клетках происходит постоянное обновление белков. Белки синтезируются, выполняют возложенные на них природой функции и подвергаются распаду. Образование новых белков связано с использованием в качестве субстратов свободных аминокислот. Поэтому важную роль в обеспечении биосинтеза белка играет обеспечение клетки аминокислотами.
У многоклеточных организмов одним из основных источников аминокислот являются экзогенные (пищевые) белки. Подвергаясь гидролизу в процессе пищеварения, они распадаются на смесь составляющих их аминокислот, которые затем поступают в клетки тканей внутренних органов и используются для построения собственных белков клеток.
У животных и человека распад белков пищи происходит в желудочно-кишечном тракте. Этот процесс обеспечивается существованием особой группы энзимов – пептидгидролаз (пептидаз), которые объединяются термином “протеолитические” ферменты. Их действие проявляется в гидролизе пептидных связей:

Протеолитические ферменты подразделяются на две основные группы:
1. Эндопептидазы, которые гидролизуют внутренние пептидные связи в молекуле белка. К ним относятся пепсин, трипсин, химотрипсин, коллагеназа и др.
2. Экзопептидазы, которые гидролизуют концевые пептидные связи в полипептидной цепи. В зависимости от того, на каком конце молекулы находится гидролизуемая связь, они разделяются на две подгруппы (рис. 116):
· карбоксипептидазы (карбоксипептидаза А), гидролизующие С-кон-цевую пептидную связь;
· аминопептидазы, гидролизующие N-концевую пептидную связь.

Рисунок 116 – Гидролиз пептидных связей в белковой молекуле
различными группами пептидгидролаз
(аминокислотные остатки представлены в виде кружков)
Переваривание белков начинается в желудке. Оно происходит здесь под действием соляной кислоты и пепсина.
Соляная кислота образуется в обкладочных клетках слизистой оболочки желудка. Исходным субстратом для ее образования служит углекислый газ. Под влиянием фермента карбангидразы он превращается в угольную кислоту (рис. 117).

Рисунок 117 – Механизм образования соляной кислоты
в слизистой оболочке желудка (КА – карбоангидраза)
Угольная кислота подвергается диссоциации. Освобождающийся при этом протон перемещается в просвет желудка в обмен на входящий в клетку К+. Этот противоположно направленный транспорт катионов (антипорт) обеспечивается Н+-АТФазой мембраны обкладочной клетки. Он сопровождается потреблением энергии, источником которой является АТФ. Одновременно с антипортом Н+ и К+ из клетки в просвет желудка выделяется анион Cl–. В результате этого в желудочном соке накапливается свободная соляная кислота.
Соляная кислота выполняет ряд важных функций в процессе переваривания белков в желудке:
· будучи крепкой минеральной кислотой, она денатурирует белки. В результате этого увеличивается доступность белковых молекул действию пепсина;
· принимает участие в образовании активного пепсина;
· формирует рН среду, благоприятную для действия пепсина.
Пепсин представляет собой эндопептидазу, которая катализирует гидролиз внутренних пептидных связей в молекуле белков. Он синтезируется в главных клетках слизистой оболочки желудка в виде зимогена (профермента) – пепсиногена. Пепсиноген представляет собой белок, состоящий из одной полипептидной цепи с молекулярной массой около 40 КДа, не обладающий каталитическими свойствами. Его превращение в активный пепсин происходит в просвете желудка. Здесь полипептидная цепь пепсиногена расщепляется на два фрагмента (рис. 118).

Рисунок 118 – Превращение пепсиногена в пепсин
Фрагмент полипептидной цепи с молекулярной массой 33 КДа, представляет собой молекулу пепсина. Второй продукт распада – ингибиторный фрагмент, состоящий из 42 аминокислотных остатков – представляет собой N-концевую молекулу пепсиногена. Распад полипептидной цепи пепсиногена может происходить либо под действием свободной соляной кислоты, либо аутокаталитически, под действием уже существующих молекул активного пепсина.
Внутриклеточный синтез протеолитических ферментов в виде проферментов имеет глубокий биологический смысл, так как в условиях образования в клетке зимогена предупреждается ее самопереваривание.
Характерным свойством пепсина является низкая величина оптимума рН, соответствующая сильнокислой реакции среды (1–1,5), которая обеспечивается присутствием в желудочном соке свободной соляной кислоты. Подобно другим ферментам пепсин обладает субстратной специфичностью. Он расщепляет только те пептидные связи, в образовании которых участвуют аминокислоты с кислыми (аспарагиновая и глутаминовая кислоты) и ароматическими (тирозин, фенилаланин) радикалами. Поэтому под влиянием пепсина не происходит полного расщепления белковых молекул. Продукты пептического гидролиза представляют собой смесь пептидов, которые являются своеобразными осколками перевариваемых белковых молекул. Все они поступают в кишечник, где подвергаются дальнейшему гидролизу под влиянием ферментов поджелудочной железы и кишечника.
В начальном отделе тонкого кишечника переваривание продуктов пептического гидролиза белков происходит под влиянием ферментов поджелудочной железы. К ним относятся:
· трипсин;
· химотрипсин;
· карбоксипептидаза А;
· коллагеназа;
· эластаза.
Все эти ферменты образуются в клетках поджелудочной железы в виде соответствующих зимогенов. Их активация происходит непосредственно в просвете кишечника.
Центральную роль в активации протеолитических ферментов в кишечнике играет трипсин. Этот фермент образуется из трипсиногена – неактивного предшественника, полипептидная цепь которого состоит из 249 аминокислотных остатков. В процессе образования активного трипсина от N-конца молекулы трипсиногена отщепляется гексапептид (фрагмент полипептидной цепи, состоящий из шести аминокислотных остатков). Это превращение осуществляется при помощи фермента энтерокиназы, образующегося клетками кишечника. Энтерокиназа обладает субстратной специфичностью. Она гидролизует пептидную связь между остатками лизина и изолейцина в молекуле трипсиногена, что и приводит к образованию активного трипсина (рис. 119).

Рисунок 119 – Механизм образования активного трипсина из
трипсиногена (молекула белка изображена в форме прямой линии
определенной длины)
Помимо энтерокиназы, в образовании трипсина из трипсиногена, может участвовать активный трипсин, т.е. процесс идет аутокаталитически.
Трипсин принимает участие в образовании активных форм других протеолитических ферментов в кишечнике (рис. 120).

Рисунок 120 – Активация протеолитических ферментов
под влиянием трипсина в тонком кишечнике
Все эти ферменты, за исключением карбоксипептидазы А, представляют собой эндопептидазы. Они проявляют каталитические свойства при рН 7–8 и специфичность в отношении гидролизуемой связи. Так, трипсин катализирует гидролиз связей, в образовании которых участвуют карбоксильные группы аргинина и лизина, химотрипсин – связи, образованные карбоксильными группами ароматических аминокислот, лейцина, метионина и др., карбоксипептидаза А – пептидные связи на С-конце полипептидной цепи, за исключением тех, в образовании которых принимают участие лизин, аргинин и пролин.
В результате совместного действия всех этих ферментов полипептидные цепи распадаются до коротких пептидов, состоящих из 2–5 аминокислотных остатков дипептидов, трипептидов, тетрапептидов и др. Они подвергаются окончательному гидролизу до аминокислот в процессе пристеночного пищеварения под действием аминопептидаз кишечного сока – (экзопептидаз, отщепляющих терминальные аминокислотные остатки с N-конца). В качестве продукта переваривания при этом образуются свободные аминокислоты. Образовавшиеся в процессе гидролиза пищевых белков свободные аминокислоты всасываются в кровь и разносятся к тканям внутренних органов.
Распад белков происходит и в клетках. Внутриклеточный распад белков может происходить двумя различными путями:
1) при помощи протеолитических ферментов лизосом (катепсинов);
2) при помощи протеосом.
Протеосомальный путь распада белков является энергозависимым, сопряженным с потреблением АТФ. В нем подвергается гидролизу большинство внутриклеточных белков. Именно этот путь принимает участие в разрушении “старых“ белков.
Обмен свободных аминокислот внутри клетки связан с их распадом или использованием для биосинтеза белка и других анаболических процессов. Внутриклеточный пул аминокислот складывается из поступающих в клетку (экзогенных), а также образующихся в ней в биосинтетических реакциях и при распаде внутриклеточных белков (эндогенных) аминокислот. Аминокислоты, способные синтезироваться в клетках, относятся к заменимым аминокислотам. В организме человека к незаменимым аминокислотам относятся: глютаминовая кислота, глютамин, аспарагиновая кислота, аспарагин, аланин, глицин, тирозин, серин, пролин и цистеин. Остальные 10 стандартных аминокислот являются незаменимыми. Они должны поступать в организм с пищей. При нарушении их поступления (при голодании) происходит угнетение процесса синтеза белков в организме.
Основными путями использования свободных аминокислот в процессе обмена веществ являются:
· биосинтез белков и пептидов;
· синтез небелковых азотсодержащих веществ – пуринов, пиримидинов, порфиринов, холина, креатина, меланина, некоторых витаминов, коферментов (НАД, коэнзим А), медиаторов (ацетилхолин), гормонов (адреналин, норадреналин, тироксин) и других биологически активных веществ (гистамин, серотонин);
· синтез моносахаридов (глюконеогенез);
· биосинтез липидов;
· распад с образованием конечных продуктов обмена.
Для каждой аминокислоты существуют свои, специфические пути обмена, которые определяются строением их аминокислотного радикала. Кроме этого, все аминокислоты могут подвергаться превращениям в общих путях катаболизма. К ним относятся:
· декарбоксилирование,
· трансаминирование,
· дезаминирование.
1. Декарбоксилирование – это процесс отщепления первичной карбоксильной группы от аминокислот в форме углекислого газа. Он катализируется декарбоксилазами, ферментами, у которых в качестве кофермента используется пиридоксальфосфат. Ниже представлена реакция декарбоксилирования глутаминовой кислоты.

Продуктом декарбоксилирования являются амины, которые в норме образуются в очень небольших количествах и обладают высокой биологической активностью. Так, при декарбоксилировании гистидина образуется гистамин:
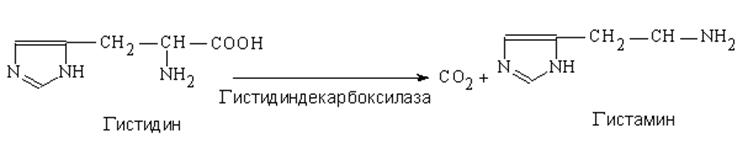
Из глутаминовой кислоты при декарбоксилировании образуется γ-аминомасляная кислота, из фенилаланина и тирозина – дофамин, из триптофана – триптамин, из цистеина – таурин и т.д.
2. Трансаминирование. В процессе трансаминирования происходит взаимодействие аминокислоты и кетокислоты, в результате которого образуются новая аминокислота и новая кетокислота. Схематически процесс трансаминирования его можно представить в следующем виде:

Почти все аминокислоты, за исключением лизина и треонина, подвергаются трансаминированию. Этот процесс катализируется ферментами аминотрансферазами (трансаминазами), которые обладают групповой специфичностью. Коферментами аминотрансфераз являются пиридоксальфосфат и фосфопиридоксамин, представляющие собой производные витамины В6. Процесс трансаминирования сложен и протекает через ряд последовательных стадий.
Трансаминирование используется в процессе синтеза заменимых аминокислот и непрямого дезаминирования, а также в некоторых специфических путях катаболизма аминокислот.
3. Дезаминирование. Представляет собой процесс отщепления α-ами-ногруппы от аминокислоты с образованием аммиака в качестве продукта реакции. Существует несколько видов дезаминирования:

Особую роль в дезаминировании аминокислот играет процесс окислительного дезаминирования. Окислительное дезаминирование катализируют оксидазы L- и D-аминокислот, которые представляют собой флавиновые дегидрогеназы. В организме животных и человека особое значение в дезаминировании аминокислот имеет окислительное дезаминирование глутаминовой кислоты. Этот процесс катализируется глутаматдегидрогеназой. Коферментом этого энзима является НАД.

Образующийся при дезаминировании аминокислот свободный аммиак обладает высокой реакционной способностью. В этой связи он проявляет свойства цитотоксического вещества, накопление которого в организме приводит к его отравлению. По этой причине в процессе эволюции в живых организмах были сформированы особые пути детоксикации аммиака.
|
Просмотров 1616 |
|
|
