
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Механизм стадий процесса биосинтеза белка
|
|
Рассмотрим в деталях особенности каждой стадии процесса биосинтеза белка.
Основными участниками первой стадии являются молекулы т-РНК и аминокислоты. Как уже ранее отмечалось (гл. 4), т-РНК представляют собой сравнительно небольшие одноцепочные полинуклеотиды, в состав которых входит несколько десятков нуклеотидных остатков. Каждой аминокислоте соответствует, как минимум, одна специфическая т-РНК.
На 5'-конце их полинуклеотидной цепи т-РНК, как правило, находится гуаниловый нуклеотид (G), a на 3'-конце – нуклеотидная последовательность – С-А-А. В состав молекулы в значительном количестве входят минорные мононуклеотиды. Минорные мононуклеотиды содержат азотистые основания, которые являются производными характерных для РНК азотистых оснований (дигидроурацил), или не характерные для РНК азотистые основания (тимин).
Внутри молекулы, состоящей из одной полинуклеотидной, возникают связи между комплементарными азотистыми основаниями. За счет них т-РНК приобретает характерную укладку в пространстве, имеющую подобие клеверного листа (рис. 145).
В молекуле т-РНК выделяется несколько функциональных образований. Среди них – акцепторная ветвь. Этот участок находится на 3'-конце полинуклеотидной цепи. Он принимает участие в связывании аминокислоты. Другое характерное образование – антикодоновая ветвь содержит специфический триплет нуклеотидов (антикодон), комплементарный в антипараллельном направлении кодону м-РНК.
Присоединение аминокислоты к т-РНК происходит с помощью фермента аминоацил-т-РНК-синтетазы. В клетке существуют более 20 их разновидностей. Для каждой аминокислоты существует, как минимум, один энзим, проявляющий по отношению к ней высокую субстратную специфичность.

Рисунок 145 – Пространственная укладка молекулы т-РНК
(показаны связи между комплементарными азотистыми основаниями
мононуклеотидов, включенных в одну полинуклеотидную цепь,
сближенных в пространстве в процессе ее укладки)
Аминокислота взаимодействует с т-РНК согласно следующей схеме:

Реакция происходит в две стадии. Нa первой стадии в активном центре фермента образуется фосфорилированная форма аминокислоты – аминоациладенилат. Далее aминоацильный остаток передается на cooтветствующую т-РНК. Присоединение аминокислотного остатка происходит ко второму или третьему углеродному атому пентозы, входящей в состав адениловой кислоты на 3'-конце полинуклеотидной цепи (рис. 146).

Рисунок 146 – Присоединение аминокислоты к т-РНК
(показана структура, располагающегося на 3’- конце остатка адениловой кислоты, к которому присоединяется аминокислота)
Образовавшаяся аминоацил-т-РНК используется в процессе построения полипептидной цепи белковой молекулы. При этом т-РНК играет роль своеобразного “адаптера”.
На второй стадии процесса биосинтеза белка происходит образование инициирующего комплекса – особой структуры, способной к началу синтеза полипептидной цепи на основе информации, заложенной в структуре матричной РНК. Основу структуры инициирующего комплекса составляет рибосома (рис. 147).
Рибосомы представляют собой внутриклеточные нуклеопротеидные образования. В их состав входят около 65 % р-РНК и около 35 % белка. Рибосома состоит из двух неравных по массе субчастиц – большой (50 S) и малой (30 S). Большая субчастица включает в состав две молекулы рибосомальной РНК разной массы и 34 различных белка. Малая субчастица содержит одну молекулу РНК и 21 молекулу белка. Все составные компоненты рибосомы принимают непосредственное участие в белковом синтезе.

Рисунок 147 – Строение рибосомы прокариот
Обе субъединицы рибосомы неплотно связаны друг с другом так, что между ними остается особое образование – щель. Щель между субчастицами рибосомы необходима для того, чтобы в процессе синтеза полипептидной цепи через нее продвигалась м-РНК. Связь между субчастицами не прочная. Поэтому при определенных условиях они могут диссоциировать.
Рибосомы эукариот и прокариот имеют схожую структуру, но различаются массой субчастиц. У эукариот они значительно больше по массе и имеют более сложный белковый состав.
Процесс построения полипептидной цепи у всех белков начинается с С-конца. Ее построение всегда начинается с метионина (у эукариот) или его N-формильного производного (у прокариот). В этой связи метионин считается инициирующей аминокислотой.
Образование инициирующего комплекса происходит в три этапа.
1. Малая субчастица рибосомы (30 S) связывает особый белковый фактор инициации IF-3, препятствующий ассоциации субчастиц рибосомы. Субчастицы диссоциируют и рибосома прекращает свое существование как единое целое (рис. 148). К освободившейся малой субчастице присоединяется м-РНК. Присоединение происходит строго определенным образом. Ориентация м-РНК относительно малой субчастицы обеспечивается входящей в ее состав р-РНК.
В результате присоединения м-РНК ее первый (инициирующий) кодон (AUG), кодирующий метионин, оказывается в строго определенном участке 30 S-субчастицы.
2. К инициирующему кодону присоединяется аминоацильный комплекс инициирующей аминокислоты (метионина или формилметионина), с которым связан белковый фактор инициации IF-2 и ГТФ (Мет – т-РНК + IF-2 + ГТФ). Присоединение происходит за счет образования связей между комплементарными азотистыми основаниями инициирующего кодона м-РНК и антикодона т-РНК, нагруженной аминокислотой, связанной с IF-2 и ГТФ.
3. Пpoисходит гидролиз ГТФ. За счет освобождающейся при этом энергии от комплекса отделяются факторы IF-2 и IF-3. После того как от малой субчастицы удаляется фактор IF-3, она вновь приобретает способность соединяться с большой субчастицей. Присоединение большой субчастицы (50S) приводит к образованию инициирующего комплекса.
В инициирующем комплексе выделяются два функционально неравнозначных участка:
· А – аминоацилъный,
· Р – пептидилъный.
В пептидильном участке находится соединенная с т-РНК инициирующая аминокислота, присоединенная к инициирующему кодону м-РНК. В аминоацильном участке инициирующего комплекса находится второй по счету кодон м-РНК. В дальнейшем все поступающие на рибосомы комплексы аминокислот с т-РНК присоединяются к А-участку.

Рисунок 148 – Образование инициирующего комплекса:
А – аминоацильный участок, Р – пептидильный участок
Таким образом, в состав инициирующего комплекса входит рибосома, к которой присоединена м-РНК, с инициирующим кодоном которой связан аминоацильный комплекс инициирующей аминокислоты с т-РНК.
После образования инициирующего комплекса начинается третья стадия белкового синтеза, во время которой происходит построение полипептидной цепи белка. Присоединение каждого аминокислотного остатка к строящейся полипептидной цепи осуществляется в три стадии (рис. 149).
1. Используемые для биосинтеза белка аминоацил-т-РНК присоединяют особый белковый фактор элонгации (Tu) и ГТФ. При этом образуется тройной комплекс аминоацил-т-РНК – Tu – ГТФ.
Комплекс, в состав которого входит соответствующая аминокислота, присоединяется к кодону м-РНК, локализованному в А-участке рибосомы. Присоединение происходит лишь в том случае, если антикодон т-РНК оказывается комплементарным кодону м-РНК. Образование комплекса сопровождается гидролизом ГТФ и, в последующем, удалением продукта гидролиза – ГДФ, а также белкового фактора Tu. Важную роль в обеспечении всех этих превращений на рибосоме играет фактор элонгации Ts.
2. Между аминокислотами, связанными с т-РНК, находящимися в аминоацильном и пептидильном участках рибосомы образуется пептидная связь. Для этого аминокислота из Р-участка переносится в А-участок. Здесь при помощи фермента пептидилтрансферазы, локализованного в большой субчастице рибосомы, она присоединяется к связанной с т-РНК аминокислоте и становится N-концевой. По этой причине инициирующая аминокислота в синтезирующемся белке всегда является N-концевой.
В результате всех перечисленных выше событий в участке А рибосомы образуется дипептидил-т-РНК, а в участке P остается “пустая” т-РНК.

Рисунок 149 – Механизм образования полипептидной цепи
на рибосоме (трансляции)
3. На следующем этапе м-РНК перемещается вдоль рибосомы в сторону 3'-конца на расстояние, равное одному кодону. В результате подобного перемещения “пустая” т-РНК освобождается из P-участка в цитозоль. При этом в пептидильном участке оказывается дипептидил-тРНК, а А-учас-ток становится свободным.
Процесс передвижения м-РНК по рибосоме (транслокация) является энергозависимым и осуществляется при участии особого белкового фактора элонгации – G (транслоказы). Энергетическое обеспечение процесса происходит за счет энергии, освобождающейся при гидролизе одной молекулы ГТФ.
После освобождения А-участка рибосомы появляется возможность для нового присоединения аминоацил-т-РНК и последовательность событий, происходящих на этой стадии, повторяется. В результате к полипептидной цепи присоединяются остатки аминокислот. Последовательность присоединения аминокислот определяется информацией, заложенной в первичной структуре (нуклеотидной последовательности).
Присоединение последней аминокислоты в полипептидную цепь знаменует начало 4-й стадии белкового синтеза – терминации. Начало этой стадии предопределяет появление на рибосоме одного из трех терминирующих кодонов м-РНК, следующих непосредственно за триплетом нуклеотидов, кодирующих включение в полипептидную цепь последней аминокислоты.
К терминирующим кодонам относятся триплеты нуклеотидов, которые имеют следующую структуру:

Они не кодируют аминокислот и представляют собой так называемые бессмысленные триплеты. При попадании в А-участок рибосомы терминирующего кодона начинают действовать три фактора терминации – Rl, R2 и R3 (рилизинг-факторы). Под влиянием этих факторов происходит следующее:
· гидролитическое освобождение полипептида от т-РНК, включенной в Р-участок;
· отсоединение от P-участка “пустой” т-РНК;
· диссоциация рибосомы на составляющие ее субчастицы.
Эффективность считывания информации в клетках с м-РНК повышается за счет образования полисомных комплексов (рис. 150). При этом информация с одной молекулы м-РНК одновременно считывается сразу несколькими рибосомами, как бы нанизанными на нее. Биологическая целесообразность образования полисом связана с тем, что время жизни м-РНК очень мало. Образовавшиеся в процессе транскрипции молекулы очень быстро разрушаются в цитозоле под влиянием рибонуклеаз.
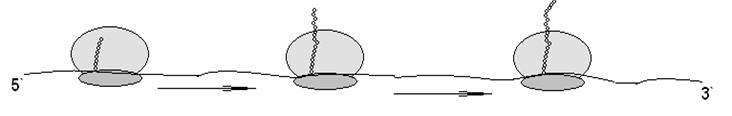
Рисунок 150 – Полисомный комплекс (три рибосомы на мРНК)
Синтезированный на рибосоме полипептид, как правило, не обладает характерной для данного белка биологической активностью. Поэтому далее необходимо его своеобразное “созревание”, которое происходит на заключительной пятой стадии процесса белкового синтеза – посттрансляционном процессинге.
В основе посттрансляционного процессинга лежат различные типы ковалентных превращений полипептидной цепи: уменьшение длины полипептидной цепи, за счет гидролитического отщепления от нее отдельных аминокислот с С- или N-конца, а также пептидных фрагментов разной длины. Участником этих превращений являются ферменты пептидазы.
Ковалентная модификация аминокислотных остатков, включенных в полипептидную цепь, может достигаться путем фосфорилирования аминокислот, содержащих гидроксильную группу в радикале (серин, треонин, тирозин), карбоксилирования радикалов глутаминовой и аспарагиновой кис-лот, метилирования, гликозилирования (присоединение гликозидных остатков к аспарагиновой кислоте, серину или треонину), присоединения простетических групп (фосфобиотина, гема, флавиновых коферментов и др.).
В результате превращений, происходящих на стадии посттрансляционного процессинга, молекула белка приобретает характерную для нее длину и присоединяет свойственный ей небелковый компонент. Все это обеспечивает возможность формирования нативной конформации полипептидной цепи и связанное с ней образование активных участков молекулы (активных центров, участков связывания), определяющих возможность выполнения белком, характерной для него функции.
Регуляция синтеза белка
Особая роль белков в жизнедеятельности клеток предопределяет существование тонких механизмов регуляции их биосинтеза. Регуляция биосинтеза белка имеет принципиальное значение в регуляции обменных процессов, так как позволяет приспосабливать его под сиюминутные потребности клетки.
Регуляция биосинтеза белка осуществляется на двух основных уровнях:
· уровне транскрипции,
· уровне трансляции.
В регуляции биосинтеза белка на уровне трансляции принимают участие антибиотики. К ним относятся:
1. Пуромицин. Обладая сходством с 3'-концом РНК, он присоединяется к С-концу растущей полипептидной цепи и тем самым прерывает процесс ее образования на стадии элонгации.
2. Тетрациклины.Связываются с А-участком рибосомы, за счет чего тормозят образование полипептидной цепи на стадии элонгации.
3. Хлорамфеникол. Подавляет синтез митохондриальных белков.
4. Стрептомицин. Вызывает ошибки в считывании генетической информации.
Свойство антибиотиков подавлять биосинтез белков в микроорганизмах находит применение в лечении инфекционных заболеваний.
Особое место в регуляции биосинтеза белка приобретают механизмы, реализуемые на уровне транскрипции. В основе современных представлений по этому вопросу лежат исследования французских ученых Франсуа Жакоба и Жака Моно из Пастеровского института. Их экспериментальные исследования по регуляции образования β-галактозидазы E. coli. легли в основу гипотезы оперона.
Гипотеза оперона базируется на основе экспериментальных данных о субстратной индукции белков E. coli. при выращивании на среде с лактозой (индукция β-галактозидазы, галактопермиазы и А-белка) и репрессии синтеза белков (угнетение их образования) при культивации в среде с другими углеводами.
Гены, кодирующие β-галактозидазу и галактопермеазу (структурные гены), располагаются в молекуле ДНК в линейной последовательности друг за другом (рис. 151). Рядом с ними находится регуляторный ген, способный оказывать тормозящее влияние на транскрипцию структурных генов.

Рисунок 151 – Строение оперона (представлен фрагмент молекулы ДНК,
на котором обозначены структурные гены –G1, G2 и G3, О- оператор и
р – промоторный участок)
Продуктом экспрессии регуляторного гена является белок – репрессор, который обладает способностью тормозить экспрессию структурных генов. Репрессор соединяется с особым участком на молекуле ДНК – оператором (о). В результате образования комплекса репрессора с оператором становится невозможным связывание РНК-полимеразы с промоторным участком ДНК, что делает невозможной транскрипцию структурных генов (рис. 152).
В том случае, когда в клетке появляется особое вещество – индуктор, процесс торможения белкового синтеза прекращается (рис. 152). Индуктор представляет собой вещество, которое специфически связываться с бел-ком – репрессором. В комплексе с индуктором репрессор меняет свою конформацию и утрачивает способность связываться с оператором. При этом РНК-полимераза приобретает возможность связываться с промоторным участком ДНК и осуществлять транскрипцию структурных генов, что предопределяет начало биосинтеза кодируемых ими белков.

Рисунок 152 – Репрессия структурных генов при помощи
репрессора и снятие репрессии с помощью индуктора.
Индуктор специфически связывается с белком-репрессором, в результате чего тот утрачивает способность соединяться с оператором. Следствием этого становится возможным присоединение РНК-полимеразы к промоторному участку ДНК и экспрессия структурных генов G1, G2 и G3.
В качестве индуктора могут выступать различные промежуточные продукты обмена веществ и субстраты. У E. сoli. в качестве одного из индукторов выступает моносахарид – галактоза. При отсутствии в среде культивирования этого субстрата микробная клетка не синтезирует белков, участвующих в его метаболизме и транспорте (галактозидазы и галактопермеазы). Однако если колонию E. сoli культивировать в среде, содержащей галактозу, то под ее влиянием (как индуктора) начинается синтез ферментов и транспортных белков, обеспечивающих возможность ее использования в качестве субстрата окисления и пластического материала.
На примере индукции белков у микроорганизмов видна биологическая целесообразность контроля белкового синтеза на уровне транскрипции. Этот же механизм приобретает решающую роль в процессе дифференцировки клеток многоклеточного организма.
Контрольные вопросы
1. В чем заключается биологическая целесообразность высокой специфичности аминоацил-тРНК-синтетаз?
2. Перечислите основные компоненты системы, синтезирующей белок клетки.
3. Каким образом устроена рибосома прокариот?
4. Каким образом обеспечивается энергией процесс белкового синтеза?
5. С чем связана необходимость посттрансляционного процессинга?
6. Каким образом осуществляется регуляция биосинтеза белка на стадии транскрипции?
7. Какие вещества осуществляют контроль за процессом биосинтеза белка на стадии трансляции?
|
Просмотров 1727 |
|
|
