
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Опыт 10. Химические свойства жидких алкенов
|
|
Опыт 10.1. Отношение жидких алкенов к бромной воде
В пробирку приливают 5 капель смеси жидких алкенов (бензин) и добавляют 2 капли раствора брома в СС14. Смесь перемешивают и осторожно нагревают на водяной бане. Окраска брома исчезает. В горлышко пробирки вносят влажную инди-каторную бумажку. Наблюдайте, происходит ли изменение окраски индикаторной бумажки. Бромирование протекает по реакции:
СНз-СН = СН-СН2-СНз + Вг2 " CH3-CHBr-CHBr-CH2-CH3
пентен-2 2,3-дибромпентан
Опыт 10.2. Отношение жидких алкенов к перманганату калия
В пробирку добавляют 5 капель жидких алкенов (бензин), 1 каплю раствора карбоната натрия и 4 капли раствора пер-манганата калия. Фиолетовая окраска раствора исчезает и выпа-дает бурый осадок оксида марганца (IV) . При окислении алкенов образуются двухатомные спирты
КМnО4 + Н2O + СН3-СН = СН-СН2-СН3 (пентен-2) "
МпO2 + КОН + СН3-СНОН-СНОН-СН2-СН3 (2,3-пентадиол)
Расставьте стехиометрические коэффициенты в данном уравнении.
Опыт 10.3. Действие концентрированной серной кислоты на жидкие алкены
В пробирку помещают 5 капель жидкого алкена и 5 капель концентрированной серной кислоты. Смесь взбалтывают в тече-ние 1-2 мин. При сильном разогреве пробирки ее следует охла-дить проточной водой. Наблюдают исчезновение слоя жидких алкенов и появление бурой окраски реакционной смеси.
 OSO3H
OSO3H
СН3-СН = СН-СН2-СН 3 + Н2 SО4 " СН3-СН2-СН-СН2-СН3
пентен-2 3-сульфопентан
Контрольные вопросы
1. Напишите структурные формулы изомеров гексена и назовите их.
2. Какие спирты можно получить гидратацией алкенов состава С4Н8 ?
3. Напишите уравнения соответствующих реакций.
4. Сколько литров воздуха (н.у.) необходимо для сжигания 5 литров этена, если выход по веществу составляет 80%?
5. Определите молярную массу этена, если известно, что 1,12 г его могут обесцветить 8 г 40%-ного раствора брома.
6. На полное гидрирование 2,8 г алкена израсходовано 0,896 л водорода (н.у.). Вычислить молярную массу этого соединения.
Глава 5. АЛКИНЫ
Непредельные углеводороды, содержащие в молекуле тройную связь, называют алкинами. Общая формула алкинов СnН2n -2 Первый представитель гомологического ряда алкинов - этин (ацетилен) НС : СН. Тройная связь в молекуле ацетилена представляет собой сочетание одной σ- и двух π-связей. Длина тройной связи С : С составляет 0,120 нм, что меньше длины как ординарной, так и двойной связи. Энергия тройной связи составляет 828 кДж/моль. Наличие двух π - связей обуславливает высокую химическую активность алкинов. Как и для алкенов, для них характерны реакции присоединения, окисления и полимеризации. Отличие алкинов от алкенов заключается в том, что алкины – более ненасыщенные соедине-ния. Поэтому реакции присоединения у алкинов происходят ступенчато. На первой стадии идет присоединение к тройной связи с образованием двойной связи. Реакция присоединения у алкинов протекает медленнее, чем у алкенов. На второй стадии идет присоединение к двойной связи с образованием одинарной связи.
Опыт 11. Получение и химические свойства этина
Опыт 11.1. Получение этина из карбида кальция
В пробирку помещают маленький кусочек карбида кальция, добавляют 5 капель воды и закрывают пробкой с газоотводной трубкой. В пробирке бурно выделяется газ - этин
СаС 2 + 2Н2 О " Са(ОН)2 + НС : СН (этин)
Опыт 11.2. Получение этина из 1,2-дихлорэтана
Алкины получают из галогеносодержащих алканов путем отщепления двух атомов галогена у соседних или у одного атома углерода действием спиртового раствора щелочи. В пробирку приливают 10 капель 1,2-дихлорэтана. Добавляют железные стружки, несколько крупинок песка. Затем в пробирку добав-ляют 5 капель спиртового раствора КОН. Пробирку закрывают пробкой с газоотводной трубкой В пробирке бурно выделяется газ – этин:
СН2CI-СН2CI + 2KOH " НС : СН + 2КCI + 2Н2О
Опыт 11.3. Взаимодействие этина с бромной водой
Алкины обесцвечивают бромную воду вследствие присоеди-нения брома по месту тройной связи. Процесс протекает ступен-чато:
НС : СН + Br2 " Br- СН=СН –Br (1,2-дибромэтен)
Br- СН=СН – Br + Br2 " СНBr2 - СНBr2 (1,1,2,2-тетрабромэтан).
В пробирку добавляют 5 капель бромной воды. Конец газоотводной трубки с выделяющимся газом этином (опыт 11.1) опускают в пробирку с бромной водой. Наблюдают постепенное обесцвечивание бромной воды. Объясните, почему этин обесцве-чивает бромную воду значительно медленнее, чем этен.
Опыт 11.4. Окисление этина перманганатом калия
В пробирку помещают 5 капель раствора перманганата калия, 1 каплю карбоната натрия и опускают в нее конец газоотводной трубки с выделяющимся газом этином. Раствор быстро обесцве-чивается и выпадает бурый осадок. Алкины легко окисляются с образованием карбоновых кислот. В данном случае образуется щавелевая кислота. Реакция протекает по схеме
НС : СН+KMnO4+Н2О " MnO2+KOH+H2C2O4 (щавелевая к-та)
Расставьте стехиометрические коэффициенты в данном уравнении.
Опыт 11.5. Горение этина
Поджигают этин у конца газоотводной трубки (опыт 11.1). Он горит коптящим пламенем. На фарфоровой чашечки, внесен-ной в пламя, образуется темное пятно сажи
НС : С Н + O2 " С + C O + Н2О.
При интенсивной подаче кислорода происходит полное сгорание этина по схеме
НС : С Н + O2 " CO2 + Н2О.
Расставьте стехиометрические коэффициенты в данном уравнении.
Опыт 11.6. Получение ацетиленида серебра
Важное отличие тройной связи С : С от двойной С = С состоит в том, что алкины, содержащие тройную связь в конце цепи, проявляют очень слабые кислотные свойства. Атом водорода при тройной связи обладает повышенной подвиж-ностью и способен замещаться на металл (реакция металлиро-вания). В результате образуются металлические производные – ацетилениды. Такие реакции являются качественными реак-циями на тройную связь.
В пробирку вносят 2 капли раствора нитрата серебра и при-бавляют одну капля раствора гидроксида аммония. Образуется осадок оксида серебра:
2AgNO3 + 2 NН4ОH " Ag2O + 2 Н2О + 2 NН4NO3.
В пробирку добавляют еще несколько капель раствора аммиака до растворения осадка. Осадок растворяется с образова-нием аммиачного комплекса серебра
Ag2O + 4NН4ОH " 2[Ag(NН3)2 ]OH + 3Н2О.
Через аммиачный раствор комплекса серебра пропускают этин (опыт 11.1).
В пробирке образуется желтый осадок ацетиленида серебра, который затем становится серым
НС : СН + 2[Ag (NН3 )2]OH " 4NН3 + 2Н2О + AgС : СAgÔ
(ацетиленид серебра)
Ацетиленид серебра разлагается со взрывом
AgС : СAg " 2Ag + 2С.
Остатки ацетиленида серебра уничтожают раствором соляной кислоты:
AgС : СAg + 2НСI " НС : СН + 2AgCI.
Опыт 12. Химические свойства жидких алкинов
Опыт 12.1. Бромирование жидких алкинов
В пробирку помещают 3 капли раствора брома в четырех-хлористом углероде и по каплям добавляют жидкий алкин. Окраска брома исчезает, т.к. происходит реакция присоединения бромида по тройной связи:

12.2. Окисление жидких алкинов перманганатом калия
При действии сильного окислителя алкины реагируют с разрывом молекулы по тройной связи. При этом образуются две карбоновые кислоты
В пробирку помещают 3 капли алкина, 2 капли раствора перманганата калия и 1 каплю раствора карбоната натрия. Содер Розовая окраска постепенно исчезает и выпадает бурый осадок. Реакция протекает по схеме:

Расставьте стехиометрические коэффициенты в данном уравнении.
Контрольные вопросы
1. При термическом разложении 50 л метана получают смесь водорода и алкина. Определите объем полученных продук-тов, если выход продуктов составляет 70%.
2. Напишите структурные формулы изомеров гептина и назо-вите их.
3. Разделите смесь пропина–1, пропена и пропана. Напишите уравнения соответствующих реакций.
4. Определите, сколько литров воздуха необходимо для полного сжигания пяти литров этина.
5. Изобразите структурные формулы веществ: а) 3-метил-пентадиен – 1,4; б) гексин – 2.
6. При обработке 4,96 г смеси карбидов кальция и алюминия соляной кислотой было получено 2,24 литров газовой смеси. Определите количественный состав исходной смеси карбидов.
Глава 6. АРЕНЫ
К ароматическим соединениям (аренам) относится большая группа соединений карбоциклического ряда, молекулы которых содержат устойчивую циклическую группировку из шести угле-родных атомов (бензольное кольцо), обладающие особыми физическими и химическими свойствами. К таким соединениям относятся, прежде всего, бензол и его гомологи.
Общая формула аренов – Сn Н2n - 6 , то есть судя по формуле это сильноненасыщенные углеводороды. Однако для аренов не характерны реакции присоединения и окисления, а характерны реакции замещения, как для алканов. Это противоречие объяс-няет строение "бензольного кольца". Один s- и два р-электрона углерода в бензольном кольце находятся в состоянии sр2 – гибридизации. Эти гибридные орбитали связывают между собой 6 атомов углерода и 6 атомов водорода обычной σ -связью Оставшиеся p-электроны по одному от каждого углеродного атома , оси которых перпендикулярны плоскости бензольного кольца, взаимно перекрываются друг с другом. В результате сопряжения p-орбиталей шести атомов углерода образуется единое π-электронное облако, расположенное над и под кольцом, причем эти электроны не связаны с каким-либо одним атомом углерода и могут перемещаться относительно них в том или ином направлении, то есть электроны становятся делокализованными. Такое равномерное распределение электронной плотности между всеми углеродными атомами и является причиной высокой устойчивости молекулы бензола. Поэтому реакции присоеди-нения, разрушающие молекулу бензола, требуют большой затраты энергии и для бензола не характерны. Бензол не реагирует с бромной водой и не окисляется перманганатом калия. С другой стороны, в результате реакции замещения ароматическая структура сохраняется. В эти реакции вступают положительно заряженные (электрофильные) частицы, которые притягиваются к π-электронному облаку. В реакциях замещения важную роль играют катализаторы, которые способствуют образованию электрофильных частиц.
Опыт 13. Физические и химические свойства бензола.
Опыт 13.1. Растворимость бензола в различных растворителях
В три пробирки помещают по три капли бензола. В одну пробирку помещают три капли воды, в другую – три капли этилового спирта, в третью - три капли хлороформа. Содержимое пробирок перемешивают. В пробирке с водой образуется два слоя, в пробирке со спиртом и хлороформом получается однородный раствор. Убедитесь, что бензол в воде не растворим, но хорошо растворяется в органических растворителях.
Опыт 13.2. Действие бромной воды на бензол
В пробирку помещают 3 капли бромной воды и 3 капли бензола. Содержимое пробирки перемешивают и дают отстояться. Нижний слой (бромная вода) обесцвечивается, а верхний слой (бензол) окрашивается в коричневато-желтый цвет. Бром легче растворяется в бензоле, чем в воде и поэтому переходит в верхний бензольный слой (экстракция). Химическое взаимодействие брома с бензолом в этих условиях не происходит.
13.3. Действие перманганата калия на бензол
В пробирку помещают 3 капли перманганата калия и одну каплю раствора кapбoната натрия. К полученному раствору добавляют каплю бензола и содержимое пробирки перемешивают. Розовая окраска не исчезает. Бензол не окисляется.
Опыт 13.4. Горение бензола
В фарфоровую чашечку помещают 3 капли бензола и под-жигают его. Образуется коптящее пламя. Реакция протекает по схеме
С6Н6 + 3О2 " 3С + 3СО + 3Н2О.
Опыт 14.Реакции бензола, идущие по механизму электро-фильного замещения
Опыт 14.1. Бромирование бензола
Бензол взаимодействует с бромом и хлором в присутствии катализаторов – безводных хлоридов алюминия и железа, а также железных опилок. В пробирку приливают 5 капель бензола и 5 капель раствора брома в тетрахлориде углерода и добавляют на кончике шпателя немного железных опилки. Смесь нагревают на водяной бане. Наблюдайте постепенное обесцвечивание реакционной смеси. Индикаторная бумажка, смоченная водой, с помощью пинцета помещается в верхнюю часть пробирки. Отметьте изменение цвета индикаторной бумажки. Напишите уравнение реакции
С6Н6 + Br2 " HBr + С6Н5Br (бромбензол).
Опыт 14.2. Нитрование бензола
Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии нитрующей смеси (смесь концентрированных азот-ной и серной кислот) нитрование проходит довольно легко и приводит к образованию нитробензола и динитробензола
а) получение нитробензола
В сухую пробирку помещают 4 капли концентрированной азотной кислоты и 4 капли концентрированной серной кислоты. Затем в пробирку добавляют 3 капли бензола. Смесь перемеши-вают и подогревают на водяной бане в течение одной минуты, периодически перемешивая. Появляется характерный запах горького миндаля. Содержимое пробирки выливают в пробирку с водой. На дно опускается капля нитробензола. Она имеет чуть желтоватый цвет. Напишите уравнение реакции.
H2SO4 конц.
С6Н6 + НО-NO2 " Н2 О + С6Н5 NO2 (нитробензол)
б) получение динитробензола
Для получения динитробензола нужна более высокая темпера-тура и большая длительность нитрования. В пробирку помещают 4 капли концентрированной азотной кислоты и 4 капли концент-рированной серной кислоты. К нитрующей смеси приливают две капли бензола и нагревают 3-4 минуты над пламенем горелки. Затем реакционную смесь охлаждают и выливают в пробирку с водой. На дно опускается тяжелая маслянистая капля, которая быстро кристаллизуется. Уравнение реакции
. H2SO4 конц.
С6Н6 + 2НО-NO2 " 2Н2 О + С6Н4(NO2 )2 (1,3-динитробензол)
Опыт 14.3. Алкилирование бензола (реакция Фриделя-Крафтса)
При взаимодействии бензола с алкилгалогенидами в присут-ствии катализатора (хлорида алюминия) атом водорода замещается на алкил, и образуются гомологи бензола.
В пробирку помещают 4 капли бензола и добавляют 3 капли хлороформа. Затем в пробирку добавляют несколько кристал-ликов хлорида алюминия и содержимое пробирки энергично перемешивают. Постепенно появляется окраска самых разнообразных оттенков. При стоянии образуется густое масло, окрашен-ное в коричневый цвет (трифенилметан)
(AICI3)
3 С6Н6 + CHCI3 " 3HCI + (С6Н5 )3 CH (трифенилметан).
Этот опыт является качественной реакцией на любое ароматические соединение. 
Опыт 15.Химические свойства гомологов бензола
Основной тип реакций гомологов бензола – электрофильное замещение. Однако гомологи бензола имеют ряд отличных от бензола химических свойств, связанных с наличием алкилов и их влиянием на бензольное кольцо.
Опыт 15.1. Бромирование толуола
Гомологи бензола могут реагировать с галогенами не только в присутствии катализатора, но и при нагревании. Эти условия способствуют радикальному замещению атома водорода на атом галогена, которое происходит не в бензольном кольце, а в боковой цепи.
В пробирку наливают 3 капли раствора брома в тетрахлориде углерода и 4 капли толуола. Смесь нагревают на водяной бане. Наблюдайте постепенное обесцвечивание реакционной смеси. Индикаторную бумажку, смоченную водой, с помощью пинцета помещают в верхнюю часть пробирки. Отметьте изменение цвета индикаторной бумажки. Напишите уравнение реакции
С6Н5 CH 3 (толуол) + Br2 " HBr + С6Н5CH2 Br (бромистый бензил)
Опыт 15.2. Бромирование толуола в присутствии катализа-тора
В присутствии катализатора при бромировании толуола идет замещение атома водорода на атом брома в ароматическом ядре по ионному механизму. Атом галогена входит в бензольное кольцо в орто- или пара-положение по отношению к алкильному радикалу. В пробирку приливают 5 капель толуола и 5 капель раствора брома в тетрахлориде углерода и добавляют на кончике шпателя немного железных опилок. Смесь нагревают на водяной бане. Наблюдайте постепенное обесцвечивание реакционной смеси. Индикаторная бумажка, смоченная водой, с помощью пинцета помещается в верхнюю часть пробирки. Отметьте изменение цвета индикаторной бумажки.
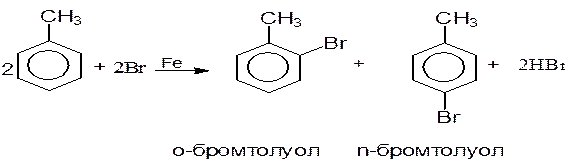
Опыт 15.3. Действие перманганата калия на толуол
Гомологи бензола обесцвечивают раствор перманганата калия за счет окисления боковых цепей. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением ближайшего к кольцу атома углерода, который окисляется в карбоксильную группу.
В пробирку наливают 5 капель толуола, 3 капли раствора пер-манганата калия и 2 капли раствора серной кислоты. Наблюдают постепенное обесцвечивание реакционной смеси. Напишите уравнение соответствующей реакции, которая протекает по схеме
С6Н5 CH 3 + KMnO4 + H2SO4 " MnSO4 + K2SO4 + Н2 О + С6Н5COOH (бензойная к-та)
Расставьте стехиометрические коэффициенты в уравнении реакции.
Опыт 15.4. Бромирование нафталина
Бромирование нафталина происходит гораздо легче, чем бромирование бензола. Для этой реакции можно использовать раствор брома в тетрахлометане и не требуется катализатор.
В сухую пробирку помещают несколько кристалликов наф-талина, приливают 4 капли раствора брома в тетрахлорметане содержимое пробирки энергично перемешивают. Нафталин постепенно растворяется и бромируется на холоду. При этом происходит выделение пузырьков HBr и исчезает окраска брома.

Контрольные вопросы
1. Напишите структурные формулы изомеров арена С8Н10 и назовите их.
2. При гидрировании 7,8 г бензола до циклогексана в присут-ствии катализатора поглотилось 3, 36 литра водорода. Определите выход циклогексана.
3. Напишите уравнение реакции получения метилбензола и о-ксилола.
4. Рассчитайте массу диоксида марганца, которая потребуется для получения хлора, необходимого для превращения 10 мл бензола, плотность которого 0,8 г/мл, в гексахлороциклогексан.
5. При нитровании гомолога бензола массой 3,5 г образовалось 7,55 г мононитропроизводных. Установите его молекулярную формулу.
|
Просмотров 3336 |
|
|
