
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Глава 11. БЕЛКОВЫЕ ВЕЩЕСТВА
|
|
Белки представляют собой биополимеры α-аминокислот, которые связаны друг с другом пептидными связями. Поэтому низкомолекулярные соединения, в которых аминокислоты соединены друг с другом пептидными связями, принято называть пептидами.
Если при гидролизе белковые вещества распадаются в конечном итоге до α-аминокислот, то мы имеем дело с так называе- мыми простыми белками, или протеинами. Но существуют и сложные белки, или протеиды, в состав которых входят остатки соединений, принадлежащих к иным классам органических и неорганических веществ (простетические группы). В состав белков помимо углерода (50-55%), кислорода (21-24%), азота (15-18%) и водорода (6-7%) могут входить P, S, Fe и другие элементы. Суточная потребность взрослого человека в белках составляет 70-80 г.
Белки имеют большую молекулярную массу (104–107 г/моль). Многие белки растворимы в воде, но образуют, как правило, коллоидные растворы, из которых выпадают в осадок при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании (денатурация).
Опыт 31. Химические свойства белков
Oпыт 31.1. Качественные реакции на белки
а) Биуретовая реакция.
В пробирку помещают 2 капли исследуемого раствора белка, I каплю раствора гидроксида натрия и I каплю раствора сульфата меди (II) . Жидкость окрашивается в фиолетовый цвет, который заметен даже в окрашенной водной вытяжке мяса. Биуретовая реакция связана с наличием в белках пептидных связей
(-СО -NН -), которые и приводят к появлению окраски с солями меди (II) .
б) Ксантопротеиновая реакция.
В пробирку помещают 3 капли водного раствора белка и I каплю концентрированной азотной кислоты. Появляется белый осадок. При нагревании реакционной смеси раствор и осадок окрашиваются в ярко-желтый цвет. Смесь охлаждают и добавляют 1-2 капли гидроксида натрия. При этом желтое окрашивание переходит в ярко-оранжевое. Ксантопротеиновая реакция обусловлена наличием в белках ароматических аминокислот. Желтое окрашивание является результатом нитрования ароматических ядер. Появление оранжевой окраски определяется образованием более интенсивно окрашенных анионов.
Oпыт 31.2. Качественные реакции на серу
При нагревании в щелочном растворе происходит выщелачивание серы в виде сульфид-ионов, которые с катионом свинца образуют черный осадок PbS. В пробирку вносят комочек белой шерстяной пряжи, приливают 5 капель раствора гидроксида натрия, 1 каплю раствора уксусной кислоты, 2 капли нитрата свинца и нагревают содержимое пробирки в пламени горелки. Появляется коричнево-черный осадок сульфида свинца. Это качественная реакция на наличие серы в белках. Напишите уравнение соответствующих реакций.
Опыт 31.3. Обратимое осаждение белков из растворов
При добавлении к водным растворам белков концентрированных растворов минеральных солей белки осаждаются (высаливаются). При осаждении они не изменяют своих свойств и при разбавлении водой вновь переходят в раствор.
В пробирку помещают 2 капли раствора белка, 2 капли насыщенного раствора сульфата аммония и содержимое пробирки слегка взбалтывают. Появляется муть выпадающего в осадок белка. Одну каплю мутного раствора приливают в другую пробирку с 4 каплями воды и перемешивают. Осадок растворяется.
Опыт 31.4. Свертывание белков при нагревании
Свертывание белков при нагревании характерно для большинства из них. Добавление нейтральных солей (сульфата аммония, хлорида натрия) облегчает и ускоряет свертывание белков при нагревании. Свертывание белков - процесс необратимого осаждения, т.к. белковые молекулы при этом меняют свою структуру.
В пробирку наливают 4 капли раствора белка и нагревают в пламени горелки до кипения. Белок при этом выделяется в виде мути или хлопьев. Содержимое пробирки слегка охлаждают, добавляют каплю раствора сульфата аммония и нагревают до начала кипения. Количество свернувшегося белка при этом увеличивается.
Опыт 31.5. Осаждение белков солями тяжелых металлов
Соли тяжелых металлов осаждают белки из растворов, образую с ними нерастворимые в воде соединения.
В две пробирки помещают по 3 капли раствора белка. В одну пробирку добавляют I каплю раствора сульфата меди (II), в другую -I каплю раствора нитрата свинца. Образуются хлопьевидные осадки или муть. С солью меди образуется осадок голубого цвета, с солью свинца - белого.
Глава 12. УГЛЕВОДЫ
Углеводы относятся к органическим соединениям, содержащим в молекуле одновременно альдегидную или кетонную группу и несколько спиртовых групп. Общая формула их Сm (H2O)n , где n,m >3.
Все углеводы можно разделить на три группы: моносахариды, дисахариды и полисахариды. Моносахариды не подвергаются гидролизу с образованием более простых углеводов. В зависимости от числа углеродных атомов в молекуле моносахариды разделяются на тетрозы (С4Н8О4) , пентозы (С5Н10О5) и гексозы (С6Н12О6). Наиболее распространенными являются гексозы (глюкоза и фруктоза). Если моносахариды содержат альдегидную группу, то они относятся к классу альдоз (альдегидоспиртов), если кетонную - к классу кетоз (кетоспиртов).
Дисахариды это продукты конденсации двух моносахаридов. Эти углеводы подвергаются гидролизу и образуют при этом простые углеводы. Самым простым дисахаридом является сахароза - С12Н22О11.
Полисахариды (крахмал, целлюлоза) образованы большим числом молекул моносахаридов.
Опыт 32. Химические свойства моносахаридов
Опыт 32.1. Обнаружение гидроксильных групп в глюкозе
Моносахариды взаимодействуют с гидроксидами тяжелых металлов подобно многоатомным спиртам. При этом водород гидроксильных групп замещается на ион металла, и образуются производные моносахаридов типа алкоголятов, называемые сахаратами. В пробирку наливают 3 капли раствора глюкозы и 10 капель раствора гидроксида натрия; затем к полученной смеси добавляют I каплю раствора сульфата меди (II) и встряхивают содержимое пробирки. Образующийся вначале голубой осадок гидроксида меди (II) мгновенно растворяется и получается прозрачный раствор, имеющий слабую синюю окраску. Образуется сахарат меди. Растворение гидроксида меди (II) при добавлении глюкозы доказывает наличие в ней гидроксильных групп. Полученный раствор сохраняют для следующего опыта. Напишите уравнение соответствующей реакции.
Опыт 31.2. Окисление глюкозы гидроксидом меди (II) в присутствии щелочи
Реакция окисления гидроксидом меди (II) характерна как для альдоз (глюкоза), так и для кетоз (фруктоза). Это связано с тем, что в щелочной среде в присутствии окислителя углеродные цепочки молекул моносахаридов расщепляются с образованием смеси веществ, которые легко окисляются гидроксидом меди (II) с образованием красного осадка оксида меди (I) . Моносахариды являются очень сильными восстановителями.
К полученному в предыдущем опыте щелочному раствору сахарата меди добавляют 5-6 капель воды (высота слоя жидкости должна быть 10-15 мм). Смесь осторожно нагревают над пламенем горелки до кипения. Раствор сначала окрашивается в оранжево-желтый цвет вследствие образования гидроксида меди (I). При более продолжительном нагревании может образоваться красный осадок оксида меди (I). Происходит следующая химическая реакция:

D- глюкоза D- глюконовая кислота
2CuOH " Cu2O + H2O
Опыт 32.3. Окисление глюкозы аммиачным раствором оксида серебра
Реакция "серебряного зеркала" является качественной реакцией на альдегидную группу. В чистую пробирку, предварительно прокипяченную с раствором щелочи, помещают каплю нитрата серебра, 2 капли раствора гидроксида натрия и приливают по каплям раствор аммиака до полного растворения образовавшегося осадка оксида серебра. Затем добавляют I каплю раствора глюкозы и слегка подогревают содержимое пробирки над пламенем горелки до начала почернения раствора. Дальше реакция идет без нагревания и металлическое серебро выделяется на стенках пробирки в виде блестящего зеркального налета. Следует помнить, что во время нагревания пробирку нельзя встряхивать, иначе серебро выпадает в виде черного осадка. В результате этой реакции образуется D –глюконовая кислота, металлическое серебро и аммиак. Напишите уравнение реакции.
Опыт 33. Химические свойства дисахаридов.
Опыт 33.1. Обнаружение гидроксильных групп в сахарозе
В пробирку помещают I каплю раствора сахарозы, 5 капель раствора гидроксида натрия и 4-5 капель воды. Добавляют каплю раствора сульфата меди (II). В пробирке образуется бледно-голубой осадок гидроксида меди (II) , который после встряхивания растворяется и образуется раствор, имеющий светло-синюю окраску вследствие образования сахаратов меди (II). Напишите уравнение соответствующей реакции. Раствор сохраняют для следующего опыта.
Опыт 33.2. Отсутствие восстанавливающей способности у сахарозы
Раствор сахарата меди, полученный в предыдущем опыте, осторожно нагревают над пламенем горелки. Раствор остается без изменения. Сахароза относится к невосстанавливающим дисахаридам.
Опыт 33.3. Реакции сахарозы с солями кобальта и никеля
В две пробирки наливают по 5 капель сахарозы и по 2 капли раствора гидроксида натрия. В одну из пробирок добавляют несколько капель сульфата кобальта. При этом раствор окрашивается в фиолетовый цвет вследствие образования сахарата кобальта. Во вторую пробирку добавляют несколько капель сульфата никеля. Раствор окрашивается в зеленый цвет в результате образования сахарата никеля. Напишите уравнения соответствующих реакций.
 Глава 13. ВЫСОКОМОЛЕКУЛЯРНЫЕ
Глава 13. ВЫСОКОМОЛЕКУЛЯРНЫЕ
СОЕДИНЕНИЯ (ПОЛИМЕРЫ)
Органические соединения в зависимости от массы молекул можно разделить на три большие группы: низкомолекулярные (с молекулярной массой до 500) , олигомеры (с молекулярной массой от 500 до 5000) и высокомолекулярные, или полимеры (со средней массой свыше 5000).
Высокомолекулярные вещества - это химические вещества с большой молекулярной массой, обладающие особыми свойствами.
Макромолекулы большинства полимеров построены из одинаковых, многократно повторяющихся групп атомов - элементарных звеньев, связанных между собой. Это позволяет для изображения многих полимеров использовать суммарные формулы, например, полиэтилен: [-CH2-CH2-]n, где n - степень полимеризации, которая показывает, сколько элементарных звеньев входит в состав молекулы полимера. От величины n очень сильно зависят свойства полимеров.
Для получения полимеров используют два типа химических реакций: реакции полимеризации и реакции поликонденсации.
Полимеризация - реакция соединения молекул мономера, протекающая за счет разрыва кратных связей и не сопровождающаяся выделением побочных низкомолекулярных продуктов, т.е. не приводящих к изменению элементарного состава мономера. Примером таких реакций служит синтез полиэтилена.
Поликонденсация - процесс образования полимеров химическим взаимодействием молекул мономеров, сопровождающийся выделением низкомолекулярных веществ (воды, хлороводорода, аммиака, спирта и др.).
При поликонденсации происходит взаимодействие между функциональными группами, входящими в состав мономеров (- ОН, -СООН, -СОН, -NH2, галогены и др.). Мономеры, вступающие в реакцию поликонденсации, должны быть не менее, бифункциональными. Примером реакции поликонденсации является синтез феноло-формальдегидных смол.
Опыт 34. Получение феноло-формальдегидных смол
В качестве исходных веществ для получения феноло-формальдегидных смол используют различные фенолы и формальдегид. В зависимости от условий проведения синтеза и соотношения компонентов получают полимеры с различной структурой и свойствами. Наиболее широкое применение нашли новолачные и резольные смолы. Новолачные смолы получают поликонденсацией фенола с формальдегидом при их соотношении 7 : 6 в кислой среде. На первом этапе фенол взаимодействует с формальдегидом, образуя соединение с метилольной группой (фенолоспирт):

гидроксиметилфенол
Гидроксиметилфенол затем вступает в реакцию поликонденсации с фенолом с образованием воды и линейного полимера - новолачной смолы:

Новолачные смолы - термопластичные полимеры.
Опыт 34.1. Получение новолачной смолы
В пробирку вносят 1 г фенола и 1,5 мл формалина. Смесь нагревают на водяной бане до получения однородного раствора, добавляют несколько капель концентрированной соляной кислоты и затем нагревают еще 5-10 мин до помутнения и расслоения содержимого пробирки. Верхний водный слой сливают, наливают в пробирку немного воды и нагревают еще 1-2 мин. Затем воду снова сливают, а смолу переносят на стекло, где через некоторое время она затвердевает. Получается смола светло-сиреневого цвета.
При поликонденсации фенола с избытком формальдегида в щелочной среде образуются термореактивные полимеры (резольные смолы), которые имеют разветвленное строение. В резольных смолах фенольные кольца соединяются метиленовыми мостиками. как в орто-, так и в пара-положениях.
Опыт 34.2. Получение резольной смолы
В пробирку помещают 2, 5 г фенола и 4 мл раствора формальдегида, затем добавляют в качестве катализатора 0, 5 мл концентрированного раствора аммиака. Пробирку погружают в водяную баню и нагревают при постоянном встряхивании в течение 10 мин. При охлаждении в пробирке выпадает смолообразный осадок резольной формальдегидной смолы красно-оранжевого цвета.
Опыт 34. 3. Получение бакелитового лака
Растворяют полученные феноло-формальдегидные смолы в этиловом спирте, получая при этом «бакелитовый лак». Полученным спиртовым раствором покрывают деревянные дощечки. После испарения спирта они оказываются покрытыми лаком.
Опыт 35.Получение мочевино-формальдегидных смол.
При взаимодействии мочевины с формальдегидом образуются мочевино-формальдегидные смолы, строение и свойства которых зависят от соотношения исходных компонентов, а также от условий проведения синтеза. При нагревании смеси мочевины и формальдегида в щелочной среде вначале образуется моно- или диметилолпроизводные мочевины:
H2N – CO – NH2 + HCOH → H2N – CO – NH – CH2OH
оксиметилмочевина
H2N – CO – NH2 + 2HCOH → HOH2C - HN – CO – NH – CH2OH диоксиметилмочевина
В кислой среде метилолпроизводные мочевины, отщепляя воду, образуют легко полимеризующиеся производные метиленмочевины:
H2N – CO – NH – CH2OH → Н2О + H2N – CO – N = CH2 (метиленмочевина)
HOH2C - HN – CO – NH – CH2OH → H2C = N – CO – N = CH2 (диметиленмочевина)
При полимеризации метиленмочевины образуется линейный полимер:
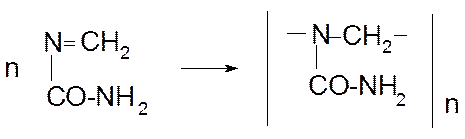
При полимеризации диметиленмочевины образуется сетчатый полимер:

В небольшом стаканчике смешивают 10 г мочевины, 15 мл 40%-ного раствора формалина и несколько капель муравьиной кислоты. Во избежание разбрызгивания раствора накрывают стаканчик стеклом и нагревают его на асбестовой сетке. Через несколько минут образуется белый порошок полимера.
Мочевино-формальдегидные смолы применяют в качестве связующих веществ при производстве древесно-стружечных плит, в качестве основы для клея при производстве фанеры и других деревянных изделий, при производстве синтетического шпона и влагостойкой бумаги, в текстильной промышленности - для аппретирования тканей (придания им несминаемости).
Приложение
Таблица 1
Предельно допустимые концентрации (ПДК) веществ в
воздухе с указанием их класса опасности.
| Вещество | ПДК мг/м3 | Класс опасности |
| Аммиак | ||
| Анилин | 0, 1 | |
| Ацетон | ||
| Ацетонитрил | ||
| Бензальдегид | ||
| Бензилхлорид | 0, 5 | |
| Бензол | ||
| Бром | 0, 5 | |
| Бутанол | ||
| Бутилацетат | ||
| Диметиламин | ||
| Диметилформамид | ||
| Диоксан | ||
| 1,2-дихлорэтан | ||
| Диэтиламин | ||
| Камфора | ||
| Ксилол | ||
| Метанол | ||
| Муравьиная кислота | ||
| Нафтол | 0, 1 | |
| Пиридин | ||
| Пропанол | ||
| Скипидар | ||
| Тетрагидрофуран | ||
| Тетрахлорметан | ||
| Триэтиламин | ||
| Уксусная кислота | ||
| Фенол | 0, 3 | |
| Продолжение табл. 1 | ||
| Формальдегид | 0, 5 | |
| Хлорбензол | ||
| Циклогексан | ||
| Этанол | ||
| Этилацетат | ||
| Этилхлорид |
Таблица 2
Константы диссоциации органических кислот
| Название | Химическая формула | Кд | рКд | |
| Предельные одноосновные кислоты: | ||||
| Муравьиная (метановая) | НСООН | 1, 78 ∙ 10-4 | 3,75 | |
| Уксусная (этановая) | СН3СООН | 1, 78 ∙ 10-5 | 4,75 | |
| Пропионовая (пропановая) | СН3СН2СООН | 1, 35 ∙ 10-5 | 4,87 | |
| Масляная (бутановая) | СН3СН2СН2СООН | 1, 55 ∙10-5 | 4,81 | |
| Изомасляная (2-метилпропановая) | (СН3)2СНСООН | 1, 44 ∙ 10-5 | 4,84 | |
| Валериановая (пентановая) | СН3(СН2)3СООН | 1, 51 ∙ 10-5 | 4,82 | |
| Капроновая кислота (гексановая) | СН3(СН2)4СООН | 1, 32 ∙ 10-5 | 4,88 | |
| Продолжение табл. 2 | ||||
| Предельные двухосновные кислоты: | ||||
| Малоновая (пропандионовая) К1 К2 | НООС-СН2-СООН | 1,35 ∙ 10-3 2,07 ∙ 10-3 | 2,87 5,68 | |
| Янтарная (бутандионовая) К1 К2 | НООС-(СН2)2- СООН | 6,89 ∙ 10-5 2,07 ∙ 10-6 | 4,16 5,61 | |
| Глутаровая (петандионовая) К1 К2 | НООС-(СН2)3–СООН | 4,57 ∙ 10-5 5,41 ∙ 10-6 | 4,34 5,27 | |
| Адипиновая (гек- сандионовая) К1 К2 | НООС-(СН2)4–СООН | 3,90 ∙ 10-5 5,11 ∙ 10-6 | 4,26 5,28 | |
| Непредельные одноосновные кислоты: | ||||
| Акриловая (пропеновая) | Н2С=СН-СООН | 5,56 ∙ 10-5 | 4,25 | |
| Кротоновая (бутеновоя) | Н3С-СН=СН-СООН | 2,04 ∙ 10-5 | 4,69 | |
| Сорбиновая (2,4-гексадиеновая) | Н3С-СН=СН-СН=СН-СООН | 1,70 ∙ 10-5 | 4,77 | |
| Пропаргиловая (пропиоловая) | НС≡С-СООН | 1,45 ∙ 10-2 | 1,84 | |
Таблица 3
Свойства L-α-Аминокислот
| Аминокислоты | Сокр. назва-ние | Химическая Формула | рК (COOH) | рК (NH2) | pI |
| Моноаминокарбоновые: | |||||
| Глицин (аминоуксусная) | Gly; (G) | H2N-CH2-COOH | 2,34 | 9,60 | 5,97 |
| Aланин (аминопропионовая) | Ala; (A) | CH3 –CH(NH2)-COOH | 2,34 | 9,60 | 6,00 |
| Валин (аминоизовалериановая) | Val; (V) | CH3 –CH(CH3)CH-CH(NH2)-COOH | 2,32 | 9,69 | 5,96 |
| Лейцин (аминоизокапроновая) | Leu; (L) | CH3 –CH(CH3)-CH2-CH(NH2)-COOH | 2,36 | 9,60 | 6,04 |
| Изолейцин (2-амино-3-метилпентановая) | Ile; (I) | CH3 –CH2 –CH(CH3)-CH(NH2)-COOH | 2,32 | 9,76 | 6,02 |
| Фенилаланин (2-амино-3-фенилпропионовая) | Phe; (F) | C6H5–CH2 –CH(NH2)-COOH | 2,58 | 9,54 | 5,91 |
| Моноаминодикарбоновые | |||||
| Аспаргиновая кислота (аминоянтарная) | Asp; D) | HOOC-CH(NH2)-COOH | 1,88; 3,65 | 9,60 | 2,77 |
| Глутаминовая кислота (аминоглутаровая) | Glu; (E) | HOOC—(CH2 )2 -CH(NH2)-COOH | 2,19; 4,25 | 9,67 | 3,08 |
| Диаминокарбоновые: | |||||
| Орнитин (2,5-диаминопентановая) | Orn | H2N-(CH2 )3-CH(NH2)-COOH | 1,94 | 8,65; 10,76 | 9,74 |
| Лизин (2,6-диаминогексановая) | Lys; (K) | H2N-(CH2 )4-CH(NH2)-COOH | 2,18 | 4,95; 10,50 | 9,74 |
| Aргинин (2-амино-4 гуанидиновалериановая) | Arg; (R) | HN=C(NH2)-NH-(CH2 )3-CH(NH2)-COOH | 2,18 | 9,09; 13,20 | 10,74 |
| Гидроксиаминокислоты | |||||
| Серин (2-амино-3-гидроксипропионовая) | Ser; (S) | HO-CH2-CH(NH2)-COOH | 2,21 | 9,15 | 5,68 |
| реонин (2-амино-3-гидроксимасляная) | Thr; (T) | CH3-CH(OH)-CH(NH2)-COOH | 2,71 | 9,62 | 6,16 |
| Тирозин [2-амино-3-(4-гидроксифенил)- пропановая] | HO-C6H4-CH2-CH(NH2)-COOH | 2,20 | 9,11 | 5,63 | |
| Тиоаминокислоты | |||||
| Цистеин(2-амино-3-меркаптопропионовая | CYS; (C) | HS-CH2-CH(NH2)-COOH | 1,71 | 8,33 | 5,07 |
| Цистин (3,3-дитиоаминопропионовая) | CYS2 | S2 [CH2-CH(NH2)-COOH]2 | 5,03 | ||
| Метионин (2-амино-4-метилтиобутановая) | Met; M | H 3С- S-CH2-CH(NH2)-COOH | 2,28 | 9,21 | 5,74 |
| Гетероциклические аминокислоты | |||||
| Триптофан [2-амино-3-(3-индолил)- пропионовая] | Trp; (W) | H7C8 –CH2 –CH(NH2)-COOH | 2,38 | 9,39 | 5,89 |
Библиографический список
1. Артеменко А.И. Органическая химия - М.: Высшая школа, 2000.
2. Березин Б.Д., Березин Д. Б. Курс современной органической химии. – М.: Высшая школа, 2003.
3. Каррер П. Курс органической химии.- Л.: Госхимиздат, 1962.
4. Иванов В.Г., Гева О.Н., Гаверова Ю.Г. Практикум по органической химии. – М.: Высшая школа, 2000.
5. Артеменко А.И, Тикунова И.В. Ануфриев Е.К. Практикум по органической химии. – М.: Высшая школа, 2001.
Оглавление
Введение 3
Глава 1.Основные правила и организация работы в
лаборатории органической химии 4
1.1.Правила техники безопасности при работе в
химической лаборатории 4
1.2.Правила техники безопасности при работе с металлическим натрием 6
1.3.Правила техники безопасности при работе
с токсичными веществами 6
1.4.Оказание медицинской помощи при ожогах и
отравлениях химическими веществами 7
Глава 2. Качественный элементный анализ органических
соединений 8
Глава 3. Алканы 15
Глава 4.Алкены 18
Глава 5.Алкины 21
Глава 6.Арены 25
Глава 7.Галогенопроизводные органических
соединений 31
Глава 8.Спирты 34
Глава 9.Альдегиды и кетоны 42
Глава 10. Карбоновые кислоты 48
Глава 11.Белковые вещества 67
Глава 12.Углеводы 69
Глава 13.Высокомолекулярные соединения 72
Приложение 77
Библиографический список 83
Сергей Анатольевич Блинников
Пришлецова Татьяна Дмитриевна
Органическая химия
Учебное пособие

Подписано в печать 21.06.2011 г. Т.- 500 экз.
Формат 60 х 84/16. Объем 5 уч.-изд. л.
Печать ротационно-трафаретная. Бумага офисная.
. Заказ №
Редакционно-издательский отдел ФГОУ ВПО МГУП
Отпечатано в лаборатории множительной техники
ФГОУ ВПО МГУП
127550, Москва, ул. Прянишникова, 19
|
Просмотров 1810 |
|
|
