
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Глава 7. СЕРОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
|
|
Многие органические соединения, содержащие в молекуле серу, близки к аналогичным кислородсодержащим соединениям. Однако, рассматривая эти вещества, необходимо учитывать особенности строения атома серы. Являясь аналогом кислорода, сера в тоже время отличается от него своей переменной валентностью и меньшей электроотрицательностью. В органических соединениях сера проявляет валентность равную двум, четырем и шести и образует следующие классы (типы) соединений.

Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
Тиолы можно рассматривать как производные сероводорода, в котором один атом водорода замещен радикалом. Они являются аналогами спиртов и фенолов.
Номенклатура тиолов подобна номенклатуре оксипроизводных, только вместо суффикса «ол» применяется «тиол» или вместо префикса «гидрокси (окси)» – применяется «меркапто–». Эти соединения называются еще меркаптанами, тиоспиртами, тиофенолами.

Сульфиды и дисульфиды являются производными сероводорода H2S и H2S2, в которых оба атома водорода замещены углеводородными остатками. Они являются аналогами простых эфиров и пероксидов.

Способы получения
1.Алкантиолы получают реакциями алкилирования сероводорода и его солей

2.Арентиолы обычно получают восстановлением аренсульфонилхлоридов

3. Сульфиды получают алкилированием алкан- и арентиолятов или неорганических сульфидов



Для получения диарилсульфидов используют реакцию галогенидов серы с аренами в присутствии кислот Льюиса

4. Дисульфиды получают окислением тиолятов или алкилированием неорганических дисульфидов

Физические свойства
Тиолы представляют собой бесцветные соединения с чрезвычайно неприятным запахом, который обнаруживается уже в ничтожных концентрациях (1:4∙108). Связь S–H менее полярна, чем связь О–Н, поэтому у тиолов слабее межмолекулярные водородные связи и ниже температуры кипения, чем у соответствующих кислородных аналогов.
Сульфиды и дисульфиды также бесцветные вещества с неприятным запахом. Их температуры кипения выше, чем у аналогичных простых эфиров и пероксидов.
Химические свойства
1. Тиолы. Реакции тиолов обусловлены главным образом ионизацией связи S–H и нуклеофильными свойствами атома серы.
1.1) тиолы являются SH-кислотами, причем значительно более сильными, чем аналогичные ОН-кислоты

Характерно, что только тиолят ртути содержит ковалентную связь Hg–S.
1.2) тиолы и особенно тиоляты легко окисляются. При действии слабых окислителей продуктом реакции являются дисульфиды. Сильные окислители превращают тиолы в сульфоновые кислоты

1.3) тиолят-ион является сильным нуклеофилом и легко алкилируется:

1.4) тиолы и дисульфиды взаимодействуют с молекулярным хлором с образованием сульфенилхлоридов. Сульфенилхлориды под действием щелочи образуют сульфеновые кислоты:



Сульфиды и дисульфиды
2.1) Химические свойства сульфидов и дисульфидов определяются главным образом большой подвижностью электронной системы атома серы. Они легко образуют донорно-акцепторные комплексы с различными ионами металлов,галогенами и другими кислотами Льюиса:

2.2) Но в тоже время сульфиды являются очень слабыми основаниями

2.3) Сульфиды легко алкилируются с образованием солей сульфония:

2.4) Слабые окислители (например пероксид водорода) позволяют получить из сульфидов сульфоксиды, а более сильные окислители – сульфоны:

К классу сульфидов относится боевое отравляющее вещество кожно-нарывного действия – иприт (β, β′-дихлордиэтилсульфид). Это бесцветная жидкость (tкип 217оС) с чесночным запахом. Иприт можно получить по схеме:
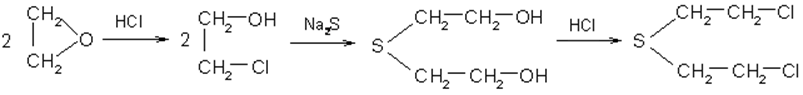
Для дегазации иприта используется хлорная известь или хлорамин Б и Т. Дегазаторы превращают иприт в сульфоксиды и другие вещества.
|
Просмотров 6323 |
|
|
