
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

ГЛАВА 8. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
|
|
8.1 НИТРОСОЕДИНЕНИЯ: определение, изомерия, номенклатура.
Нитросоединениями называются органические вещества, содержащие в качестве функциональной группы нитрогруппу –NO2. Атом азота нитрогруппы непосредственно связан с углеродом в отличие от эфиров азотистой кислоты, содержащих функциональную группу –ОNO, где связь осуществляется через кислород. Эфиры азотистой кислоты изомерны нитросоединениям:
R–NO2 – нитросоединение
R–ONO – эфир азотистой кислоты
Изомерия. Номенклатура. Строение нитрогруппы
В зависимости от природы органического радикала, с которым соединена нитрогруппа, различают нитросоединения алифатические (предельные и непредельные), алициклические, ароматические и гетероциклические. По характеру углеродного атома, связанного с нитрогруппой, нитросоединения подразделяются на первичные, вторичные и третичные (подобно галогенопроизводным и спиртам). В состав молекулы может входить одна или несколько нитрогрупп.
По номенклатуре ИЮПАК нитрогруппа обозначается как заместитель с указанием ее положения в углеродной цепи цифрой:

Строение нитрогруппы может быть обозначено следующими формулами, в соответствии с которыми один из атомов кислорода образует с азотом двойную, другой – семиполярную связь:

Эти формулы вскрывают причину полярности нитросоединений, однако в реальной молекуле связи обоих атомов кислорода с азотом не отличаются друг от друга. В нитрогруппе появляется мезомерия: связи имеют промежуточный характер, распределение электронной плотности выравнивается. Поэтому более точное строение нитрогруппы передают следующие формулы:

Способы получения
Получение нитросоединений, по М. И. Коновалову, нитрованием в газовой фазе; из галогенопроизводных, а также в ароматическом ряду действием нитрующей смеси рассмотрено в гл.3,8,9
Физические свойства
Нитросоединения жирного ряда – жидкости, обладающие приятным запахом, перегоняющиеся без разложения.
Мононитросоединения ароматических углеводородородов – жидкие или твердые вещества, бесцветные или бледно желтые. Ароматические нитросоединения, а также алифатические с числом углеродных атомов менее четырех – тяжелее воды, а алифатические нитросоединения с числом атомов углерода 4 и более – легче воды. Все нитросоединения малорастворимы в воде, ядовиты, не вызывают коррозии металлов, их водные растворы имеют нейтральную реакцию. Нитросоединения – полярные вещества; их дипольные моменты порядка 1,17÷1,34∙10-29 Кл/м (3,5÷4,0 Д). Поэтому они кипят при более высоких температурах, чем спирты или карбонильные соединения.
В ИК-спектрах нитросоединений имеются интенсивные полосы в области длин волн 1375 и 1580 см-1.
Химические свойства
1. Восстановление. Конечными продуктами восстановления нитросоединений являются первичные амины.

2. Действие щелочей. Таутомерия нитросоединений.
Нитрогруппа, обладая сильным положительным зарядом на атоме азота, оттягивает на себя электронную плотность и увеличивает подвижность водородов у соседнего атома углерода – их способность отщепляться в виде протона. Подвижность α-водородных атомов первичных и вторичных нитросоединений проявляется в их способности реагировать со щелочами с образованием солей. Это объясняется тем, что в щелочной среде нитросоединения перегруппировываются в аци-нитроформу (кислотную):

Таким образом, нитросоединения следует рассматривать как таутомерные вещества, реагирующие в нитро- и аци-нитроформах.
Если щелочные растворы нитросоединений обработать минеральной кислотой, то происходит медленный обратный сдвиг равновесия:

Поэтому нитросоединения относят к псевдокислотам. Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, тем не менее, образуют нейтральные соли щелочных металлов. «Нейтрализация» нитросоединений основаниями (образование нейтральных солей) идет медленно, а нейтрализация истинных кислот происходит, как известно, мгновенно.
3. Подвижность α-водородных атомов проявляется при взаимодействии первичных и вторичных нитросоединений с альдегидами:

Эта конденсация идет по альдольно-кротоновому типу.
4. Первичные и вторичные нитросоединения реагируют с азотистой кислотой, а третичные не реагируют:


Щелочные соли нитроловых кислот в растворе имеют красный цвет. Псевдонитролы в растворах и в расплавах окрашены в синий или зеленовато-синий цвет.
5. Соли аци-формы первичных и вторичных нитросоединений на холоду в водных растворах при действии минеральных кислот образуют альдегиды или кетоны (в момент выделения аци-форма подвергается гидролизу):

6. Влияние нитрогруппы в ароматическом ядре.
Нитрогруппа относится к заместителям второго рода: оттягивая электроны из ароматического ядра она уменьшает его активность в реакциях электрофильного замещения. Вступающий заместитель направляется в мета-положение:

Электронная плотность особенно сильно уменьшается в орто- и пара-положениях к нитрогруппе. Обедненные электронной плотностью орто- и пара-положения ядра приобретают частичный положительный заряд, а вместе с тем и способность к необычным для ароматических соединений реакциям нуклеофильного замещения:

Оттягивая электронную плотность из ядра, нитрогруппа повышает кислотность стоящих в орто- и пара-положениях гидроксильных групп. Пикриновая кислота ведет себя, как настоящая кислота (сила ее превышает силу угольной кислоты) – образует соли, эфиры со спиртами.
Под влиянием нитрогруппы увеличивается реакционная способность галогена, стоящего в орто- и пара-положениях:

Задачи для самопроверки
1. Изобразите структурные формулы нитрометана, нитроэтана и 2-нитропропана и укажите вид химической связи в этих соединениях.
2. Назовите следующие соединения:

3. Напишите структурные формулы нитросоединений состава С5Н11NO2 и назовите их.
4. Напишите структурные формулы нитросоединений, изомерных бутиловому эфиру азотной кислоты. Укажите первичные, вторичные и третичные нитросоединения.
5. Напишите аци-нитро-таутомерные формы для следующих соединений:

С помощью каких реакций можно доказать наличие таутомерных форм?
6. Предложите способ получения нитроэтана из ацетилена. Напишите реакции нитроэтана с формальдегидом, азотистой кислотой, щелочью, восстановления.
7. Дегидратацией продукта конденсации нитросоединения с карбонильным соединением получен 3-нитро-3-гексен. Установите строение исходных нитросоединения и карбонильного, а также напишите реакцию конденсации.
8.2 АМИНЫ: определение, изомерия, номенклатура
Аминами называются производные аммиака, полученные замещением в нем атомов водорода на углеводородные радикалы

В зависимости от числа атомов водорода, замещенных радикалами, различают первичные, вторичные или третичные амины. При этом не имеет значения, какие радикалы (первичные, вторичные или третичные) являются заместителями.
Изомерия. Номенклатура
Изомерия аминов зависит от положения аминогруппы в углеродной цепи и от количества и строения радикалов, связанных с атомом азота.
Названия аминов обычно производят от названий входящих в их состав радикалов с добавлением окончания – амин:
СН3−NH2 - метиламин, (CH3−CH2)2NH - диэтиламин,
(CH3)3N - триметиламин
В номенклатуре ИЮПАК аминогруппу рассматривают как функцию и ее название «амино-» ставят перед названием основной цепи, с указанием ее положения цифрой:

Оба эти амина являются первичными.
Способы получения
1. Действие аммиака на галогенпроизводные (реакция Гофмана). При этом получается смесь различных аминов:

Смесь аминов обрабатывают щелочью и подвергают перегонке с водяным паром, а гидроксид полностью замещенного аммония [(CH3)4N]+OH− остается в перегонной колбе. Разделение аминов производят, пользуясь их различной реакционной способностью.
2. Пропусканием паров спирта и аммиака при 3000С над катализатором (Al2O3; ThO2) получают смесь первичных, вторичных и третичных аминов с преобладанием первичных:

3. Амиды кислот при расщеплении гипобромитом или гипохлоритом дают первичные амины (перегруппировка Гофмана):

4. Восстановление различных азотосодержащих соединений: нитросоединений, нитрилов, изонитрилов, оксимов или гидразинов:


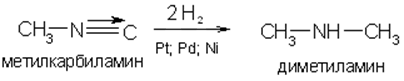
Физические свойства
Простейшие амины – газы, хорошо растворимые в воде и обладающие аммиачным запахом (метиламин, диметиламин, триметиламин). Остальные низшие амины – жидкости с запахом аммиака. Более сложные амины – жидкости с запахом рыбы. Высшие амины – твердые вещества лишенные запаха. С увеличением молярной массы аминов увеличивается их плотность, повышается температура кипения и уменьшается растворимость в воде. При равном числе углеродных атомов выше всего температура кипения первичных аминов и ниже всего третичных (за счет ассоциации в результате образования водородных связей).
Простейшие амины в отличие от аммиака горят на воздухе.
В ИК-спектрах первичных и вторичных аминов наблюдается поглощение в области 3300 – 3500 см–1, отвечающее валентным колебаниям N–H связи. Полосы поглощения располагаются в области длин волн 1100 – 1300 см–1 и трудно идентифицируются.
Химические свойства
В химическом отношении амины очень сходны с аммиаком: вступают в различные реакции как нуклеофильные реагенты. Как и аммиак, амины обладают основными свойствами, что объясняется связыванием протонов в слабо диссоциирующий катион замещенного аммония. Основность ароматических аминов понижена.
1. Амины с минеральными кислотами дают соли, которые под действием более сильного основания вновь дают свободные амины:

2. Амины вступают в реакцию алкилирования. (См. способы получения аминов: реакция Гофмана).
3. Амины можно ацилировать, в частности ацетилировать, действуя уксусным ангидридом или хлористым ацетилом:

4. Первичные амины могут быть окислены до нитросоединений или других продуктов окисления:

Следовательно, при использовании аминов в различных синтезах, аминогруппу необходимо защищать при действии окислителей. Такой защитой является реакция ацилирования аминов (см. пункт3)

5. Действие азотистой кислоты.
Эта реакция имеет важное аналитическое значение, так как позволяет различать первичные, вторичные и третичные амины.
а) При действии азотистой кислоты на первичные алифатические амины (кроме метиламина) выделяется свободный азот и образуется спирт:

Реакцию удобнее вести с солью азотистой кислоты в присутствии минеральной кислоты.
б) При взаимодействии первичных ароматических аминов с азотистой кислотой образуются соли диазония:

в) Алифатические и ароматические вторичные амины с азотистой кислотой образуют N-нитрозамины:
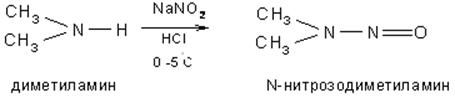
г) Третичные алифатические амины с азотистой кислотой не реагируют, а третичные ароматические амины образуют п-нитрозосоединения:

6. При слабом нагревании ароматических первичных аминов с ароматическими альдегидами легко образуются шиффовы основания или азометины:

7. При нагревании первичных ароматических аминов с хлороформом и спиртовой щелочью получаются карбиламины или изонитрилы .

8. Благодаря склонности к образованию σ-комплексов в о- и п- положениях к аминогруппе ароматические амины легко вступают в реакции электрофильного замещения. При этом получаются главным образом п-продукты:


В реакциях сульфирования аминогруппа не требует защиты.
Понятие о диаминах
Соединении, содержащие две амино группы в молекуле, называются диаминами:
NH2-CH2-CH2-NH2 этилендиамин, 1,2-диаминоэтан
NH2-CH2-CH2-CH2-CH2-NH2 тетраметилендиамин, 1,4-диаминобутан
NH2-CH2-CH2-CH2-CH2-CH2-NH2 пентаметилендиамин, 1,5-диаминопентан
Диамины могут быть получены теми же способами, что и моноамины: восстановлением динитросоединений, взаимодействием аммиака с дигалогенпроизводными, восстановлением динитрилов и т.д.
Низшие диамины растворимы в воде и являются более сильными основаниями, чем моноамины.
Диамины образуют соли с двумя эквивалентами кислот, могут алкилироваться и ацилироваться с участием как одной, так и обеих аминогрупп.
Некоторые диамины – путресцин и кадаверин (тетраметилендиамин, пентаметилендиамин) образуются при декарбоксилировании аминокислот в результате жизнедеятельности многих микроорганизмов.
Задачи для самопроверки
1. Какова электронная конфигурация атома азота в триметиламине?
2. Напишите структурные формулы всех возможных изомеров аминов состава С4Н11N. Укажите первичные, вторичные и третичные амины.
3. Напишите реакции, с помощью которых из этилена можно получить: а) этиламин, б) пропиламин, в) метиламин, г) триэтиламин.
4. Предложите реакции, позволяющие осуществить следующие превращения:
а) этиленовый углеводород → 3-метил-2-бутанамин;
б) предельный углеводород → метил-трет-амиламин
Приведите реакции характерные для каждого из этих аминов.
5. Используйте ацетон для получения изопропиламина. Напишите для изопропиламина реакции с хлористым ацетилом, азотистой кислотой, окислителем.
6. Напишите уравнения реакций, соответствующие схеме; назовите все органические вещества:


7. При действии азотистой кислоты на амин, состава С6Н15N, выделяется азот и образуется спирт С6H14O и алкен С6Н12, озонолизом которого получают ацетальдегид и метилэтилкетон. Установите строение амина и напишите все перечисленные реакции.
8.3. ДИАЗО- и АЗОСОЕДИНЕНИЯ: определение, изомерия, номенклатура
Ароматическими диазосоединениями называют различные по строению, однако легко взаимопревращаемые соединения: соли диазония, диазогидроксиды, соли диазогидроксидов – диазотаты, диазоцианиды и другие подобные вещества.
Диазосоединения ArN2X – это органические вещества с функциональной группой, составленной из двух атомов азота и соединенных с ароматическим радикалом и неорганическим остатком Х. Среди диазосоединений наиболее важными являются соли диазония.
Соли диазония состоят из диазокатиона и аниона, например [C6H5N2]+Cl– (хлористый бензол диазоний). По своему характеру они подобны аммонийным солям.
Генетически связаны с солями диазония азосоединения, которые имеют функциональную группу того же состава, имеющую строение –N=N– и стоящую между двумя ароматическими радикалами: Ar–N=N–Ar.
Несимметричные структуры (R-N=N-R′) называют, прибавляя в качестве приставки название радикала R-N=N- (арилазо-) к названию родоначального углеводорода. В качестве родоначального углеводорода RH выбирают ту часть молекулы, которая содержит заместитель, обозначаемый окончанием в названии соединения, например

Способы получения
Общий и важнейший способ получения диазосоединений заключается в действии азотистой кислоты на соли первичных ароматических аминов (реакция диазотирования).
Практически вместо неустойчивой в свободном состоянии азотистой кислоты берут ее соль и сильную минеральную кислоту (соляную, серную) в количестве, достаточном для образования соли амина, выделения азотистой кислоты из ее соли и сохранения кислой среды после окончания процесса. Избыток кислоты необходим для стабилизации соли диазония:
Ar-NH2 + NaNO2 + 3HCl → [Ar-N≡N]+Cl− + NaCl + 2H2O
Диазосоединения почти никогда не выделяют в твердом виде (это опасно из-за взрывчатости сухих диазосоединений), а используют непосредственно раствор для дальнейших превращений.
Если требуется получить свободную соль диазония, то реакцию диазотирования проводят в каком-либо органическом растворителе с помощью эфиров азотистой кислоты. Тогда соль диазония выпадает в осадок:
 8.3.2 Физические и химические свойства
8.3.2 Физические и химические свойства
Реакции диазосоединений отличаются большим разнообразием. Их обычно разделяют на две группы – реакции с выделением азота и реакции без выделения азота. Первые имеют большое значение для синтеза разнообразных ароматических соединений, вторые – служат основой отрасли промышленности – получение азокрасителей.
|
Просмотров 9697 |
|
|
