
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Антибиотики тетрациклинового ряда и их полусинтетические аналоги
|
|
Природные тетрациклины. К этой группе относятся полиоксиполикарбонильные соединения, основой химической структуры которых является частично гидрированный цикл тетрацена (нафтацена):

В медицине применяют тетрациклин и окситетрациклина дигидрат.
Тетрациклин был получен в 1953 году путём каталитического гидрирования хлортетрациклина, впервые выделенного из почв в 1948 г М. Дуггаром.
Окситетрациклин отличается от тетрациклина наличием гидроксила в положении 5, поэтому их общая формула имеет вид

Для получения природных антибиотиков тетрациклинового ряда используют микроорганизмы Streptomyces aureofaciens и Streptomyces rimosus.
По физическим свойствам природные тетрациклины — кристаллические вещества желтого или светло-желтого цвета, без запаха. Растворы в хлороводородной кислоте вращают плоскость поляризованного света влево, поэтому удельное вращение является одной из физических констант, подтверждающих подлинность (табл. 33.1).
33.1. Свойства природных тетрациклинов
| Лекарственное вещество | Химическая структура | Описание |
| Tetracycline— тетрациклин |  4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,6,10,12,12а-пентаокси-6-метил-1,11-дикетонафтацен-2-карбоксамид
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,6,10,12,12а-пентаокси-6-метил-1,11-дикетонафтацен-2-карбоксамид
| Желтый кристаллический порошок без запаха. Гигроскопичен. Удельное вращение от –265 до –275° в пересчете на сухое вещество (1%-ный раствор в 0,1 М растворе хлороводородной кислоты) |
| Oxytetracycline— окситетрациклин |  4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,6,10,12,12а-гексаокси-6-метил-1,11-дикетонафтацен-2-карбоксамида дигидрат
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,6,10,12,12а-гексаокси-6-метил-1,11-дикетонафтацен-2-карбоксамида дигидрат
| Светло-желтый кристаллический порошок без запаха. Удельное вращение от –188 до –200° (1%-ный раствор в 0,1 М растворе хлороводородной кислоты) |
Тетрациклин и окситетрациклина дигидрат являются основаниями, поэтому тетрациклин очень мало растворим, а окситетрациклин практически нерастворим в воде; оба умеренно растворимы в этаноле. В воде и этаноле тетрациклин растворяется медленно. В хлороформе и эфире они практически нерастворимы или мало растворимы. Тетрациклин и окситетрациклина дигидрат легко растворимы в разведенных кислотах и щелочах, т.к. являются амфотерными соединениями. Обладают основными свойствами обусловленными наличием в молекуле диметиламиногруппы и поэтому вступают во взаимодействие с органическими и неорганическими кислотами (в частности, глюконовой, янтарной, яблочной, борной), образуя непрочные соли. Проявляют кислотные свойства за счет фенольных и енольных гидроксилов и дают соли с гидроксидами щелочных металлов. Образуют нерастворимые внутрикомплексные соединения (хелаты) с полизарядными катионами (кальция, магния, алюминия, железа, меди).
Указанные химические свойства лежат в основе испытаний доброкачественности тетрациклинов.
В качестве общих реактивов на тетрациклины используют соли меди (II), цинка, образующие окрашенные комплексы и разбавленную хлороводородную кислоту, в присутствии которой растворы тетрациклинов приобретают желтое окрашивание с зеленоватым (тетрациклин) оттенком или оранжево-красную окраску (окситетрациклин).
Подлинность тетрациклинов устанавливают с помощью цветных реакций. Реактивом, позволяющим отличать антибиотики друг от друга, является концентрированная серная кислота, под действием дегидратирующего воздействия которой образуются окрашенные ангидропроизводные:

В среде концентрированной серной кислоты ангидропроизводные тетрациклина окрашиваются в фиолетовый цвет, а окситетрациклина — в пурпурно-красный. При последующем добавлении к окрашенному раствору тетрациклина хлорида железа (III) фиолетовая окраска переходит в коричневую или красно-коричневую.
Окситетрациклина дигидрат под действием хлорида железа (III) в спиртовой среде приобретает коричневую окраску. Образование окрашенных продуктов обусловлено наличием фенольных гидроксилов в молекулах.
Способность тетрациклинов окисляться с образованием окрашенных продуктов позволяет использовать для их идентификации такие окислители, как хлорамин Б, селенистая кислота, нингидрин в различных растворителях. Указанные реактивы позволяют идентифицировать тетрациклины и отличать их друг от друга.
Известны также цветные реакции на антибиотики этой группы с нитропруссидом натрия, n-диметиламинобензальдегидом, реактивом Несслера. Наличие в молекулах фенольных гидроксилов обусловливает образование имеющих красное окрашивание азокрасителей при взаимодействии с различными диазосоединениями, которые присоединяются в положении 9:

Для качественного анализа антибиотиков тетрациклинового ряда используют также их способность образовывать в определенных условиях флуоресцирующие продукты. Так, при действии раствором гидроксида натрия происходит изомеризация с образованием изотетрациклина, имеющего голубую флуоресценцию в УФ-свете после нагревания в кипящей водяной бане.
Тетрациклин и окситетрациклин имеют в молекулах по две системы сопряженных связей и поэтому характеризуются наличием двух полос электронного поглощения. Для аналитических целей представляет интерес длинноволновая полоса, обусловленная присутствием в молекулах карбонильных групп. Удельный показатель поглощения (ФС) раствора тетрациклина при длине волны 380 нм должен быть равен 380-419 (раствор сравнения — 0,1 М хлороводородная кислота). Подлинность окситетрациклина подтверждают по величине оптической плотности (0,54-0,58) 0,002%-ного раствора в хлороводородной кислоте при длине волны 353 нм.
Подлинность тетрациклинов по ФС и МФ подтверждают, используя метод ТСХ. Тетрациклин растворяют в метаноле и хроматографируют относительно стандартных образцов на пластинках с закрепленным слоем силикагеля марки КСК 2,5 или пластинках «Сорбфил» в системе ацетон — вода (10:1,4). Для окситетрациклина используют систему этилацетат — ацетон — вода (20:19:1). После высушивания пластинку выдерживают в парах аммиака и просматривают в УФ-свете (366 нм). Зоны испытуемых и стандартных образцов должны быть идентичными.
При выполнении испытаний на чистоту по ФС в тетрациклине устанавливают спектрофотометрическим методом присутствие светопоглощающих примесей (при длине волны 430 нм). Величина оптической плотности должна быть не более 0,5. При аналогичном испытании 0,2%-ного раствора окситетрациклина оптическая плотность при 430 нм должна быть не более 0,25, а при 490 нм — не более 0,2. Методом ТСХ подобно испытанию подлинности обнаруживают присутствие специфических примесей (гидрохлоридов 4-эпитетрациклина, ангидротетрациклина, ангидро-4-эпитетрациклина). Указанные примеси ФС рекомендует устанавливать также методом ВЭЖХ. Методом ГЖХ определяют содержание остаточных растворителей (метанола, изооктанола).
Тетрациклин количественно определяют методом неводного титрования 0,1 М раствором хлорной кислоты. Титруют в смеси муравьиной, ледяной уксусной кислоты и диоксана (5:10:10). Эквивалентную точку устанавливают потенциометрически.
Сравнительные исследования показали сопоставимые результаты при количественном определении окситетрациклина биологическим (по ГФ XI) и дифференциальным спектрофотометрическим методами. В качестве растворителя использован 0,01 М раствор хлороводородной кислоты, аналитическая длина волны 353 нм. Разработана также методика дифференциального фотоколориметрического определения тетрациклина гидрохлорида с использованием в качестве реактива хлорамина Б в щелочной среде.
Биологическую активность тетрациклиновых антибиотиков определяют способом диффузии в агар с тест-культурой Bacillus subtilis (ГФ XI, вып. 2, с. 210). Один микрограмм химически чистого лекарственного вещества соответствует специфической активности равной одной единице действия. Следовательно, 1,0 г соответствует 1 000 000 ЕД.
Оценку биологической активности природных тетрациклинов можно также осуществить методом обратной турбидиметрии с тест-культурой Staphylococcus aureus 209 P. Степень мутности измеряют на фотоэлектроколориметре со светофильтром №7 (582 нм).
Применяют также способы фотоколориметрического определения, основанные на использовании цветных реакций с раствором хлорида железа (III), с диазосоединениями, хлорамином Б в щелочной среде и другими реактивами. Известны способы флуориметрического определения.
Лекарственные препараты тетрациклинов хранят по списку Б, в сухом, защищенном от света месте, при комнатной температуре. Упаковывают в стеклянные, хорошо укупоренные банки оранжевого стекла с навинчивающимися крышками, залитыми парафином (мастикой), или в другую подходящую тару.
При хранении тетрациклина и окситетрациклина наблюдается изменение окраски. На свету они темнеют. Это является следствием образования примеси 4-эпитетрациклина, ангидротетрациклина, 4-эпиангидротетрациклина и продуктов их дальнейшего превращения. Указанные вещества отличаются меньшей биологической активностью и более высокой токсичностью, чем исходные лекарственные вещества.
В растворах кислот и щелочей (с pH ниже 2), особенно при нагревании, тетрациклин и окситетрациклин легко разрушаются. Инактивация щелочных растворов обусловлена образованием изотетрациклиновых производных. Например, тетрациклин превращается в изотетрациклин:

Идентичные продукты образует окситетрациклин.
Тетрациклин и окситетрациклин — антибактериальные средства. Их механизм действия основан на подавлении биосинтеза белка микробной клетки. Применяют при пневмонии, бактериальной и амебной дизентерии, коклюше, гонорее, бруцеллезе, туляремии, сыпном и возвратном тифе и других инфекционных заболеваниях внутрь в виде таблеток, капсул, суспензий по 0,1–0,2–0,3 г 3–5 раз в день. Наружно назначают 1–3%-ные мази для лечения глазных заболеваний, ожогов, флегмон.
Полусинтетические тетрациклины. Одним из недостатков природных тетрациклинов является сравнительно высокая токсичность. В результате исследований, проведенных в нашей стране (во ВНИИА и ЛНИИА) и за рубежом, созданы полусинтетические аналоги природных тетрациклинов: доксициклин (вибрамицин), метациклин (рондомицин) и др.
Общая формула полусинтетических тетрациклинов:
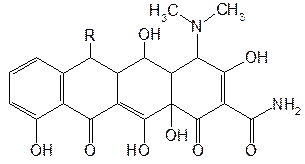
R = –CH3 или = CH2
Производные 6-дезокситетрациклина получают из окситетрациклина, изменяя структуру молекулы в положении 6. Дезоксилирование приводит к образованию доксициклина (6-дезокси-5-окситетрациклина), а последующее превращение метильной группы в метиленовую дает возможность получить метациклин (6-дезокси-6-деметил-6-метилен-5-окситетрациклин):

Способы испытаний на подлинность, чистоту и количественная оценка синтетических и природных тетрациклинов во многом сходны.
Выпускают гидрохлориды доксициклина и метациклина, которые, как и природные тетрациклины, представляют собой желтые порошки (табл.33.2).
33.2. Свойства полусинтетических тетрациклинов
| Лекарственное вещество | Химическая структура | Описание |
| Doxycycline Hydrochloride— доксициклина гидрохлорид (Вибрамицин) |  4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,10,12,12а-пентаокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамида гидрохлорида гемиэтанолата гемигидрат
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,10,12,12а-пентаокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамида гидрохлорида гемиэтанолата гемигидрат
| Желтый кристаллический порошок со слабым запахом этилового спирта |
| Methacycline Hydrochloride— метациклина гидрохлорид |  4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,10,12,12а-пентаокси-6-метилен-1,11-дикетонафтацен-2-карбоксамида гидрохлорид
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,10,12,12а-пентаокси-6-метилен-1,11-дикетонафтацен-2-карбоксамида гидрохлорид
| Желтый порошок без запаха, горького вкуса |
Доксициклина гидрохлорид легко, но медленно растворим в воде (1:3), легко растворим в метаноле (1:4) и мало — в этаноле. Метациклина гидрохлорид трудно и медленно (в течение 40 мин) растворим в воде (1:80) и в метаноле (1:40). В эфире и хлороформе оба практически нерастворимы.
Подлинность лекарственных веществ устанавливают по ИК-спектрам, сравнивая их со спектрами стандартных образцов. Методом УФ-спектрофотометрии подлинность подтверждают по удельному показателю поглощения, который у доксициклина гидрохлорида (280-310) устанавливают при длине волны 349 нм (растворитель — смесь 1 М раствора хлороводородной кислоты и метанола 1:99), а у метациклина гидрохлорида — при 345 нм. УФ-спектр раствора метациклина гидрохлорида в области 220-400 нм в том же растворителе имеет максимумы поглощения при 253 и 345 нм и минимумы при 223 и 299 нм. При длине волны 345 нм со стандартным раствором устанавливают относительную оптическую плотность метациклина, которая должна быть равна от 96 до 104%.
Доксициклин и метациклин дают цветные реакции с серной кислотой (желтое окрашивание) и хлоридом железа (III) — темное красно-коричневое окрашивание. Они дают также положительную реакцию на хлориды. Для установления подлинности и испытаний на наличие специфических примесей применяют метод ТСХ, аналогично испытаниям природных тетрациклинов.
Испытывают на наличие светопоглощающих примесей, измеряя оптическую плотность 1%-ных растворов полусинтетических тетрациклинов в смеси хлороводородной кислоты и метанола (1:99). Она должна быть не более 0,1. Методом ГЖХ в доксициклина гидрохлориде устанавливают наличие примеси этанола (4-6%), методом К. Фишера — воды (1,4-2,8%). В метациклина гидрохлориде меркуриметрическим методом количественно определяют содержание хлоридов (не менее 7,0% и не более 7,8%); в качестве индикатора используют раствор дифенилкарбазона.
Биологическую активность препаратов определяют методом диффузии в агар с тест культурой Bacillus subtilis.
Хранят лекарственные препараты полусинтетических тетрациклинов по списку Б, в сухом защищенном от света месте при комнатной температуре. Даже в темноте, особенно во влажной атмосфере и при повышении температуры, они постепенно разлагаются. Выпускают в капсулах — доксициклина гидрохлорид по 0,05, 0,1 и 0,2 г, метациклина гидрохлорид по 0,15 и 0,3 г. Показания для применения у полусинтетических тетрациклинов те же, что и у природных, но вследствие лучшей растворимости они быстрее всасываются, дольше сохраняются (до 24 ч) в крови, а также отличаются меньшей токсичностью.
ГЛАВА 34.
|
Просмотров 9224 |
|
|
