
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

ПРОИЗВОДНЫЕ ПАРА-АМИНОФЕНОЛА
|
|
Эта группа лекарственных веществ (I) имеет в своей структуре молекулу ацетанилида (II):
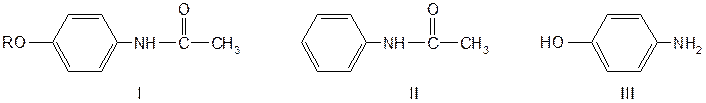
Пара-аминофенол (III) является продуктом окисления анилина. Известно, что анилин — очень токсичное метгемоглобинобразующее вещество. Вместе с тем он обладает способностью снижать температуру тела. В качестве жаропонижающего средства много лет применялся антифебрин, представляющий собой ацетанилид. Установлено, что образовавшийся в результате гидролиза ацетанилида анилин окисляется в организме до п-аминофенола. Этот процесс можно рассматривать как защитную реакцию организма, так как п-аминофенол менее токсичен и сравнительно легко выводится из организма. На основе изучения фармакологического действия производных п-аминофенола были синтезированы фенацетин и парацетамол. Создание новых лекарственных веществ на основе исследования продуктов превращения анилина в организме стало известно под названием «принципа фенацетина».
Учитывая довольно высокую токсичность фенацетина, он был в 1995 г снят с производства в России и исключён из номенклатуры. В настоящее время во всех странах мира применяют парацетамол, имеющий более 100 различных синонимов (панадол, эффералган, тайленол, ацетаминофен, парамол, парацет и др.).
Синтез парацетамола выполняют ацетилированием n-аминофенола:

п-Аминофенол получают электролитическим восстановлением нитробензола или из п-нитрохлорбензола:

В процессе синтеза п-аминофенола п-нитрохлорбензол частично гидрируется и ацетилируется, образуя весьма токсическое вещество — п-хлорацетанилид:

Известен также способ синтеза парацетамола из фенола:

36.1. Свойства парацетамола
| Лекарственное вещество | Химическая структура | Описание |
| Paracetamol— парацетамол |  n-ацетаминофенол
n-ацетаминофенол
| Белый или белый с кремоватым или розовым оттенком кристаллический порошок без запаха. Т. пл. 168–172°С |
Парацетамол (табл. 36.1) представляет собой белое кристаллическое вещество, умеренно растворимое в воде, легко растворимое в этаноле, растворимое в ацетоне и растворах едких щелочей, практически нерастворимое в эфире. Его растворимость в растворах гидроксидов щелочных металлов обусловлена наличием в молекуле свободного фенольного гидроксила.
Подлинность парацетамола подтверждают по ИК-спектру (снятому в вазелиновом масле) в области 4200-400 см–1, полосы поглощения которого должны полностью совпадать с прилагаемым к ФС рисунком спектра.
УФ-спектр 0,0005%-ного раствора парацетамола в метаноле, подкисленном хлороводородной кислотой, в области 220-350 нм имеет максимум поглощения при длине волны 249 нм. Водный раствор имеет максимум поглощения при 243 нм, а раствор в 0,001 М гидроксиде натрия — два максимума при 257 и 273 нм.
Цветную реакцию на фенольный гидроксил с раствором хлорида железа (III) используют для испытания подлинности парацетамола, в присутствии которого возникает сине-фиолетовое окрашивание.
В отличие от фенацетина при действии раствором дихромата калия и разведенной хлороводородной кислотой в присутствии парацетамола появляется неизменяющееся фиолетовое окрашивание. Фенацетин в этих условиях приобретает фиолетовое окрашивание, которое переходит в вишнево-красное. Испытание основано на реакциях гидролиза, окисления и образования производных индофенола:

Непрореагировавший n-аминофенол при взаимодействии с хинонимином образует индофенол:

Раствор парацетамола при действии азотной кислотой приобретает желто-бурую окраску. Наличие свободного фенольного гидроксила в молекуле придает растворам парацетамола восстанавливающие свойства. Поэтому при его нагревании с аммиачным раствором нитрата серебра выпадает серый осадок серебра.
Под действием реактива Марки парацетамол приобретает буро-красное окрашивание. Образовавшаяся в результате гидролиза парацетамола соль ароматического амина после добавления нитрита натрия и щелочного раствора b-нафтола образует красного цвета азосоединение за счет наличия в молекуле ароматической аминогруппы:
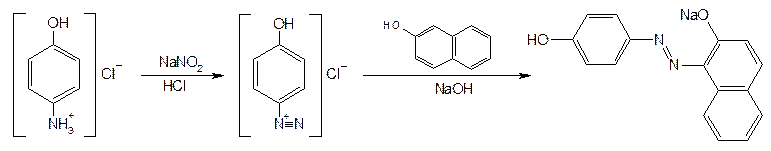
Поскольку п-аминофенол в кислой среде окисляется азотистой кислотой до хинонов, диазотируют не сам п-аминофенол, а его гидрохлорид добавлением нитрита натрия и эквивалентного количества кислоты или в присутствии солей меди (цинка).
Парацетамол также образует красного цвета азосоединение с диазореактивом за счет наличия в молекуле фенольного гидроксила:

В обоих случаях образуются азосоединения, но они различны по своему химическому строению.
Парацетамол подвергают контролю на содержание примесей промежуточных продуктов синтеза. Обнаруживают допустимое содержание примеси п-хлорацетанилида методом ТСХ на пластинках Силуфол УФ-254 или Сорбфил по отношению к СОВС п-хлорацетанилида в смеси растворителей хлороформ-ацетон-толуол (65:25:10). Оценку пятен на хроматограммах выполняют в УФ-свете при длине волны 254 нм. Устанавливают также содержание примеси свободного п-аминофенола (не более 0,005%). Для выполнения испытания предварительно готовят для контроля парацетамол, не содержащий п-аминофенола (перекристаллизацией из воды). Затем растворяют испытуемый и контрольный парацетамол в смеси метанола и воды (1:1). В качестве реактива используют свежеприготовленный раствор нитропруссида натрия. Окраска раствора испытуемого парацетамола не должна быть интенсивнее, чем у контрольного раствора.
Парацетамол при кипячении (2 мин) с разведенной хлороводородной или серной кислотой вследствие гидролиза выделяет уксусную кислоту, которую можно обнаружить по запаху:

Реакцию кислотного гидролиза используют для испытания на подлинность и в различных способах количественного определения.
Парацетамол количественно определяют по образующемуся при кипячении с обратным холодильником в течение 1 часа продукту кислотного гидролиза — гидрохлориду п-аминофенола, используя нитритометрический метод:

Эквивалентную точку устанавливают потенциометрически или с помощью внешнего индикатора — иодкрахмальной бумаги (ФС), которая синеет от выделившегося при добавлении избытка титранта иода:
NaNO2 + HCl ¾® NaCl + HNO2
KI + HCl ¾® KCl + HI
2HNO2 + 2HI ¾® I2 + 2NO + 2H2O
Эквивалентную точку при нитритометрическом определении парацетамола можно также установить со смешанным внутренним индикатором, содержащим 0,1%-ный раствор тропеолина 00 и 0,15%-ный раствор метиленового синего.
Парацетамол, являющийся слабой кислотой (pKa = 9,92), можно количественно определить в неводной среде. Растворителем служит безводный ацетон, титрантом — гидроксид калия в изопропиловом спирте. Эквивалентную точку устанавливают потенциометрическим методом в электрохимической ячейке со стеклянным электродом сравнения и сурьмяным индикаторным электродом.
Способ обратного цериметрического определения парацетамола основан на предварительном кислотном гидролизе и последующем окислении п-аминофенола избытком 0,1 М раствора сульфата церия. Процесс идет по схеме:

Точку эквивалентности устанавливают иодометрическим методом, добавляя 10%-ный раствор иодида калия и титруя выделившийся иод 0,1 М раствором тиосульфата натрия (индикатор крахмал):
2Ce(SO4)2 + 2KI ¾® I2 + Ce2(SO4)3 + K2SO4
В лекарственных формах парацетамол определяют спектрофотометрическим методом в максимуме поглощения (при 257 нм) с использованием в качестве растворителя 0,1 М раствора гидроксида натрия. Разработан способ спектрофотометрического определения парацетамола в таблетках, основанный на использовании в качестве стандартного образца дихромата калия (при длине волны 243 нм). Положительные результаты при анализе парацетамола в лекарственных формах были достигнуты методом производной спектрофотометрии. Более селективным при определении парацетамола в присутствии продуктов разложения оказался метод ГЖХ.
Фотоколориметрический метод определения парацетамола основан на образовании молибденовой сини при взаимодействии с молибдатом аммония в сильнокислой среде. Светопоглощение измеряют при длине волны 670 нм.
Парацетамол хранят по списку Б в хорошо укупоренной таре, в сухом месте. Предохраняют от действия света, чтобы не допустить гидролиза и окисления.
Парацетамол применяют по 0,2–0,5 г в качестве жаропонижающего и болеутоляющего средств.
ГЛАВА 37.
|
Просмотров 11323 |
|
|
