
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

АРОМАТИЧЕСКИЕ КИСЛОТЫ И ИХ СОЛИ
|
|
Ароматические кислоты — производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода замещены карбоксильными группами. В качестве лекарственных веществ и исходных продуктов их синтеза наибольшее значение имеют кислота бензойная (I) и кислота салициловая (II) (фенолокислота):

Константа диссоциации у кислоты бензойной имеет несколько меньшее значение (K = 6,3 × 10–5), чем у уксусной (K = 1,8 × 10–5). Аналогичными химическими свойствами обладает и кислота салициловая, однако присутствие фенольного гидроксила в ее молекуле повышает константу диссоциации до 1,06×10–3 и расширяет число аналитических реакций, которые могут быть использованы для качественного и количественного анализа. Бензойная и салициловая кислоты при взаимодействии со щелочами образуют соли.
Натриевые соли бензойной и салициловой кислот в отличие от самих кислот легко растворимы в воде. В водных растворах они ведут себя как соли сильных оснований и слабых кислот, диссоциируя на ионы натрия и, соответственно, бензоат- или салицилат-ионы.
В медицинской практике применяют кислоту бензойную, кислоту салициловую, натрия бензоат и натрия салицилат.
Бензойная кислота и её эфиры содержатся в бензойной смоле, гвоздичном масле, перуанском бальзаме.
Кислоты бензойную и салициловую получают, используя общие методы синтеза ароматических кислот. Синтезируют кислоту бензойную, окисляя толуол различными окислителями — азотной или хромовой кислотами, дихроматом калия, диоксидом марганца:

Современный промышленный способ основан на жидкофазном окислении толуола кислородом воздуха при 130-160 °C и давлении 308-790 кПа по схеме:

В химической промышленности кислоту салициловую получают карбоксилированием фенола по реакции Кольбе–Шмидта:

Выпаренную досуха смесь фенола и эквивалентного количества гидроксида натрия нагревают в автоклавах (130°C) с диоксидом углерода под давлением 450–500 кПа (4,5–5 атм). Продукт реакции растворяют в воде, подкисляют хлороводородной кислотой и выделившуюся кислоту салициловую перекристаллизовывают.
Механизм реакции Кольбе–Шмидта заключается во внедрении (электрофильной атаке) диоксида углерода в бензольное ядро в орто- и пара-положения, активированные наличием фенолята. Важную роль в этом процессе играет природа щелочного катиона. При карбонизации фенолята калия происходит образование смеси салициловой и n-оксибензойной кислот. При использовании фенолята натрия получается в основном кислота салициловая. При синтезе кислоты салициловой могут образовываться также небольшие количества оксидифенила:

Натрия бензоат и натрия салицилат получают, выпаривая досуха раствор соответствующей кислоты (бензойной или салициловой), нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:

Полученную соль перекристаллизовывают из спирта. В физических свойствах и способах испытания ароматических кислот и их солей имеются как сходства, так и различия. Все они либо кристаллы, либо кристаллические порошки. Однако форма кристаллов у них различна (по форме кристаллов кислоты можно отличить от соответствующих натриевых солей). При 370 °C кислота бензойная разлагается до бензола и диоксида углерода. Кислоты бензойная и салициловая летучи с водяным паром и при осторожном нагревании возгоняются, отличить их можно по температуре плавления (табл. 34.1).
34.1. Свойства ароматических кислот и их солей
| Лекарственное вещество | Химическая структура | Описание |
| Acidum benzoicum— кислота бензойная | 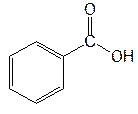 кислота бензойная
кислота бензойная
| Бесцветные игольчатые кристаллы или белый мелкокристаллический порошок. Т. пл. 122–124,5°C |
| Natrii benzoas— натрия бензоат |  натрия бензоат
натрия бензоат
| Белый мелкокристаллический порошок без запаха или с очень слабым запахом |
| Acidum salicylicum— кислота салициловая |  o-оксибензойная
кислота
o-оксибензойная
кислота
| Белые мелкие игольчатые кристаллы или кристаллический порошок без запаха. Т. пл. 158–161°C |
| Natrii salicylas— натрия салицилат |  натрия салицилат
натрия салицилат
| Белый кристаллический порошок или мелкие чешуйки без запаха |
Кислоты мало растворимы в воде (растворимы в кипящей воде), легко растворимы в этаноле и эфире. Кислота салициловая в отличие от бензойной умеренно растворима в хлороформе. Натрия бензоат легко, а натрия салицилат очень легко растворим в воде. В этаноле натрия салицилат растворим, а натрия бензоат — умеренно растворим. Обе соли практически нерастворимы в эфире. Натрия салицилат легко, но медленно растворим в глицерине.
Подлинность натрия салицилата подтверждают с помощью ИК-спектра в области 4000-400 см–1 (спресованный в таблетках с бромидом калия), который должен полностью совпадать со спектром, прилагаемым к ФС. УФ-спектр водного раствора натрия бензоата в области 220-300 нм должен иметь максимум поглощения при 226 нм. Раствор (0,001%) кислоты салициловой в 0,5 М растворе серной кислоты имеет два максимума поглощения при 235 и 300 нм.
Кислота бензойная и натрия бензоат дают характерную реакцию с раствором хлорида железа (III). Кислоту бензойную предварительно растворяют в 0,1 М растворе гидроксида натрия (реакция раствора должна быть нейтральной). В результате реакции образуется нерастворимый в воде основной бензоат железа (III) розово-желтого цвета:

Идентифицировать кислоту бензойную можно путем превращения ее в кислоту салициловую. Для этого нагревают раствор кислоты бензойной с избытком карбоната натрия и фильтруют. К нейтральному фильтрату добавляют 0,3%-ный раствор пероксида водорода и 1%-ный раствор железоаммониевых квасцов. После нагревания в течение 5 мин на кипящей водяной бане появляется фиолетовое окрашивание.
Для испытания подлинности кислоты салициловой и натрия салицилата также используют в качестве реактива раствор хлорида железа (III). Окраска и состав образующихся комплексов непостоянны и зависят от соотношения лекарственного вещества и реактива, а также от pH среды. При pH 2–3 образуется окрашенный в фиолетовый цвет моносалицилат железа (III), при pH 3–8 — красного цвета дисалицилат, а при pH 8–10 — желтого цвета трисалицилат:

При добавлении минеральных кислот указанные комплексы разрушаются, окраска исчезает и выпадает белый осадок кислоты салициловой. В присутствии уксусной кислоты окраска сохраняется, под действием ацетата натрия переходит в бурую.
Бензоат- и салицилат-ионы вступают в реакции и с другими солями тяжелых металлов. Белые осадки образуются при взаимодействии с раствором нитрата серебра. С раствором сульфата меди натрия салицилат образует зеленого цвета салицилат меди:

При нагревании кислоты салициловой или натрия салицилата с концентрированной серной кислотой и метанолом возникает резкий характерный запах метилсалицилата.
При нагревании выше температуры плавления кристаллов кислоты салициловой или нагревании ее смеси с кристаллами солей органических кислот (цитрата или ацетата натрия) происходит разложение с образованием фенола (запах) и диоксида углерода:

Образование диоксида углерода происходит и при нагревании кислоты салициловой с концентрированной серной кислотой. Диоксид углерода можно обнаружить по образованию опалесценции при пропускании выделяющегося газа через известковую воду:
Ca(OH)2 + CO2 ¾® CaCO3¯ + H2O
Кислота салициловая образует окрашенное в красный цвет соединение (ауриновый краситель) при действии раствором формальдегида в присутствии концентрированной серной кислоты (см. ч. II, 22.1).
Подлинность натрия бензоата и натрия салицилата устанавливают по иону натрия (окраска бесцветного пламени горелки в желтый цвет) и по выделению соответствующих кислот после нейтрализации растворов натриевых солей разведенной азотной кислотой. Выделившийся осадок отфильтровывают, промывают водой, сушат и идентифицируют по температуре плавления (120–124,5 °C у бензойной кислоты и 156–161°C у салициловой).
При испытании на чистоту устанавливают отсутствие или допустимые пределы примесей исходных или промежуточных продуктов синтеза (фталевая кислота, фенол, оксидифенил), а также восстанавливающих веществ и органических примесей, кислотность или щёлочность, прозрачность и цветность растворов, микробиологическую чистоту.
Способы количественного определения бензойной и салициловой кислот основаны на использовании алкалиметрического метода. В качестве растворителя используют этанол (так как кислоты мало растворимы в воде). Этанол предварительно нейтрализуют по фенолфталеину (феноловому красному). Затем растворяют навеску и титруют 0,1 М раствором гидроксида натрия (не содержащим карбонатов) с тем же индикатором:

Наличие сильной внутримолекулярной водородной связи между карбоксильной и гидроксильной группами обусловливает более активные кислотные свойства кислоты салициловой. С одним эквивалентом щелочи образуется соль по карбоксильной группе, а с избытком — также и феноксид:

Натрия бензоат, натрия салицилат, как и другие соли сильных оснований и слабых кислот, количественно определяют ацидиметрическим методом. Титруют раствором хлороводородной кислоты, используя смешанный индикатор (смесь равных количеств метилового оранжевого и метиленового синего). Титрование ведут в присутствии эфира, так как выделяющаяся кислота (бензойная или салициловая) изменяет pH водного раствора до 2,5–3,0. Это приводит к изменению окраски индикатора до наступления эквивалентной точки. Присутствие эфира предотвращает это явление, так как он извлекает выделяющуюся бензойную (салициловую) кислоту:

Количественное определение кислоты салициловой и натрия салицилата можно выполнить также бромид-броматометрическим методом, так как они являются производными фенола:
KBrO3 + 5KBr + 3H2SO4 ¾® 3Br2 + 3K2SO4 + 3H2O

Избыток брома затем определяют иодометрическим методом:
Br2 + 2KI ¾® I2 + 2KBr
I2 + 2Na2S2O3 ¾® 2NaI + Na2S4O6
Определить содержание кислоты салициловой и натрия салицилата можно иодхлорометрическим методом, основанным на иодировании этих веществ в орто- и пара-положениях до дииодпроизводных:

Затем прибавляют 10%-ный раствор иодида калия, который взаимодействует с избытком иодмонохлорида и выделившийся иод оттитровывают 0,1 М раствором тиосульфата натрия:
ICl + KI ¾® I2 + KCl
I2 + 2Na2S2O3 ¾® 2NaI + Na2S4O6
Натрия салицилат определяют (по ФС) также методом неводного титрования в среде ледяной уксусной кислоты (титрант 0,1 М раствор хлорной кислоты, индикатор кристаллический фиолетовый).
Хранят ароматические кислоты и их соли в сухом, защищённом от света месте, при комнатной температуре, в хорошо укупоренной таре, учитывая возможность возгонки кислоты бензойной и кислоты салициловой.
Применяют кислоты бензойную и салициловую наружно в качестве антисептических средств. Натрия бензоат назначают как отхаркивающее средство (в микстурах по 0,2–0,5 г или внутривенно в виде 15%-ного раствора). Кислоту салициловую назначают в качестве антисептического и кератолитического средства наружно, в виде спиртовых растворов, присыпок (2–5%-ных), мазей и паст (1–10%-ных). Натрия салицилат оказывает противоревматическое, противовоспалительное, болеутоляющее и жаропонижающее действие при приеме внутрь в дозах по 0,5–1,0 г.
ГЛАВА 35.
ПРОИЗВОДНЫЕ ФЕНОЛОКИСЛОТ
Общая характеристика
К этой группе могут быть отнесены сложные эфиры салициловой кислоты и производные амида салициловой кислоты. Салициловая кислота образует сложные эфиры как с органическими кислотами (I) за счет взаимодействия с фенольным гидроксилом, так и со спиртами или фенолами (II) за счет взаимодействия с карбоксильной группой. Производные амида салициловой кислоты имеют общую формулу (III):

|
Просмотров 9779 |
|
|
