
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Окислительное декарбоксилирование пирувата
|
|
В аэробных условиях в клетках большинства организмов пировиноградная кислота преимущественно используется в процессе окислительного декарбоксилирования.
Окислительное декарбоксилирование представляет собой сложный метаболический процесс, протекающий в митохондриях. В нем принимают участие несколько ферментов, объединенных в единый структурный ансамбль – пируватдегидрогеназный комплекс.
Пируватдегидрогеназный комплекс встроен во внутреннюю митохондриальную мембрану. Он включает три фермента: пируватдегидрогеназу (Е  ), дигидролипоилацетилтрансферазу (Е
), дигидролипоилацетилтрансферазу (Е 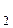 ) и дигидролипоиддегидрогеназу (Е
) и дигидролипоиддегидрогеназу (Е 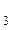 ). Для их функционирования необходимо присутствие пяти коферментов, представленных производными водорастворимых витами-нов – тиаминпирофосфата (ТПФ, витамин В1), ФАД (витамин В2), НАД (витамин В5), коэнзима А (витамин В3), и витаминоподобного вещества – амидалипоевой кислоты (ЛК).
). Для их функционирования необходимо присутствие пяти коферментов, представленных производными водорастворимых витами-нов – тиаминпирофосфата (ТПФ, витамин В1), ФАД (витамин В2), НАД (витамин В5), коэнзима А (витамин В3), и витаминоподобного вещества – амидалипоевой кислоты (ЛК).
Ниже представлена последовательность реакций, происходящих в процессе окислительного декарбоксилирования пирувата (жирным шрифтом выделены конечные продукты процесса):
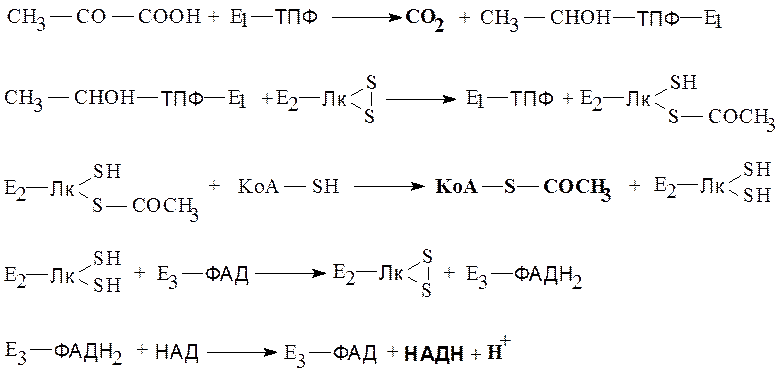
На I стадии процесса пируват подвергается декарбоксилированию. При взаимодействии с коферментом пируватдегидрогеназы (Е1) он теряет свою карбоксильную группу. Продукт декарбоксилирования, в форме гидроксиэтильного производного, оказывается связанным с ТПФ.
На II стадии гидроксиэтильная группа с кофермента пируватдегидрогеназы переносится на кофермент дигидролипоил-ацетилтрансферазы (Е2) –амидлипоевой кислоты. При этом образуется ацетильный радикал, связанный с восстановленной формой амида липоевой кислоты и освобождается редуцированная пируватдегидрогеназа (Е1).
На III стадии процесса происходит перенос ацетильной группы на коэнзим А с образованием ацетил-КоА, представляющего собой один из конечных продуктов окислительного декарбоксилирования пировиноградной кислоты.
На IV стадии происходит окисление восстановленной формы амида липоевой кислоты за счет дегидролипоилдегидрогеназы (Е3). Атомы водорода переносятся с сульфгидрильных групп амида липоевой кислоты на флавиновую простетическую группу Е3.
На V стадии восстановленный ФАД используется для восстановления НАД. При этом образуется следующий продукт окислительного декарбоксилирования пирувата – восстановленный НАД.
Балансовое уравнение окислительного декарбоксилирования пирувата может быть представлено как:
Пируват + НАД + КоА-SH = Ацетил-КоА + НАДН+Н+ + СО2
Процесс, катализируемый пируватдегидрогеназным комплексом, сопровождается значительным уменьшением свободной энергии. Поэтому он практически необратим.
Функционирование пируватдегидрогеназного комплекса подвержено тонкой регуляции. Входящий в его состав энзим пируватдегидрогеназа (Е1) является аллостерическим ферментом. Его ингибиторы – АТФ, восстановленный НАД, ацетил-КоА и высшие жирные кислоты.
Помимо аллостерической регуляции, активность пируватдегидрогеназы регулируется путем ее ковалентной модификации. В состав пируватдегидрогеназного комплекса, наряду с тремя ферментами, которые катализируют отдельные стадии процесса, входят два регуляторных фермента:
1 – киназа пируватдегидрогеназы, катализирующая фосфорилирование Е1 за счет АТФ; 2 – фосфатаза Е1, катализирующая дефосфорилирование того же энзима (рис. 89).

Рисунок 89 – Регуляция активности пируватдегидрогеназы (Е1) путем
ковалентной модификации (ПДГ- пируватдегидрогеназа)
Ковалентная модификация (фосфорилирование) пируватдегидрогеназы происходит при увеличении концентрации АТФ в клетке. Фосфорилированный фермент утрачивает каталитические свойства. Активность восстанавливается в том случае, если фермент дефосфорилируется под влиянием фосфатазы.
Основным путем обмена образовавшегося в результате окислительного декарбоксилирования пирувата ацетил-КоА является окисление в цикле трикарбоновых кислот до конечных продуктов обмена (двух молекул углекислого газа). Окисление одного ацетильного радикала сопровождается восстановлением трех молекул НАД и одной молекулы ФАД, а также образованием одной молекулы ГТФ.
Окисление каждой молекулы восстановленного НАД в дыхательной цепи может обеспечивать синтез трех молекул АТФ, а восстановленного ФАД – двух молекул АТФ. В этой связи энергетический эффект окисления одной молекулы ацетил-КоА в цикле Кребса соответствует 12 молекулам АТФ.
Таким образом, в аэробных условиях происходит окисление глюкозы до конечных продуктов обмена – углекислого газа и воды. Этот процесс складывается из трех основных стадий (рис. 90).

Рисунок 90 – Стадии процесса полного аэробного распада глюкозы
На первой стадии происходит окисление глюкозы до пирувата в гликолитических реакциях. На второй стадии продукт гликолиза – пировиноградная кислота подвергается процессу окислительного декарбоксилирования с образованием ацетил-КоА. На третьей стадии ацетил-КоА подвергается окислению в цикле Кребса.
Для расчета энергетического эффекта полного аэробного окисления глюкозы необходимо суммировать энергетические эффекты каждой стадии этого процесса:
1. В процессе гликолиза синтезируются две молекулы АТФ и две молекулы восстановленного НАД (образующегося в глицеральдегид-3-фосфат-дегидрогеназной реакции), из которого при окислении в дыхательной цепи может возникать
2 х 3 = 6 АТФ.
Итого, в процессе гликолиза при окислении молекулы глюкозы в аэробных условиях может образоваться
2 + 6 = 8 АТФ.
2. Из двух молекул пирувата, образующихся в процессе гликолиза, при окислительном декарбоксилировании синтезируется две молекулы восстановленного НАД. При их окислении в дыхательной цепи митохондрий может образовываться
2 х 3 = 6 АТФ.
3. При окислении в цикле Кребса двух молекул ацетил-КоА, образующихся из двух молекул пирувата, в процессе его окислительного декарбоксилирования, образуется (3 х 2) молекулы восстановленного НАД, (1 х 2) молекулы восстановленного ФАД и (1 х 2) молекулы ГТФ (АТФ). Всего при окислении в дыхательной цепи восстановленных коферментов может образоваться 2 х 3 х 3 = 18 АТФ и 2 х 1 х 2 = 4 АТФ.
Итого: 18 + 4 + 2 = 24 АТФ.
Суммируя количество молекул АТФ, образующихся в процессе полного аэробного окисления глюкозы, получаем 8 + 6 + 24 = 38 АТФ.
Итого, энергетический баланс полного аэробного окисления глюкозы составляет 38 АТФ в расчете на одну молекулу глюкозы.
Сравнивая энергетический эффект аэробного и анаэробного окисления глюкозы, можно придти к выводу о значительном преимуществе (2/38) аэробного окисления глюкозы. Вместе с тем при условиях, когда доступность кислорода ограничена, клетка использует анаэробный гликолиз, как основной источник энергетического обеспечения.
В аэробных условиях две молекулы НАД, восстановленного в глицеральдегиддегидрогеназной реакции гликолиза могут быть использованы для окисления в дыхательной цепи митохондрий, в результате чего образуется соответствующее количество АТФ (что было учтено при расчете энергетического баланса полного аэробного окисления глюкозы). Однако гликолитические реакции проходят в цитозоле клетки, а дыхательная цепь локализуется во внутренней митохондриальной мембране. При этом внутренняя митохондриальная мембрана непроницаема ни для окисленного, ни для восстановленного НАД. В этой связи возможность использования цитозольного восстановленного НАД для окисления в дыхательной цепи, может быть связана с существованием особых механизмов переноса восстановленного НАД внутрь митохондрий. Действительно, в процессе эволюции были сформированы особые системы переноса цитозольного восстановленного НАД в матрикс митохондрий, которые получили название “челночные системы”.
|
Просмотров 7316 |
|
|
