
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Глава 2 ТЕОРЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ
|
|
Типы химических связей
Взаимное влияние непосредственно связанных между собой атомов зависит в первую очередь от их природы и характера связи между ними.
Различают два основных типа химической связи: ковалентную и электровалентную (ионную).
Электровалентная (ионная) связь образуется между атомами значительно отличающимися по электроотрицательности:
Nao + Clo → Na+Cl–
Эта связь не характерна для органических соединений.
Ковалентная связь возникает в результате обобщения неспаренных валентных электронов. Атомы с одинаковой или близкой по значению электроотрицательностью находясь на достаточно близком расстоянии перекрываются атомными орбиталями с образованием единой связывающей молекулярной орбитали на которой и располагаются оба электрона:
Н  + Н
+ Н  → Н
→ Н  Н
Н
Разновидностью ковалентной связи является координационная(донорно-акцепторная) связь. При ее возникновении пару электронов, связывающих два ядра, представляет только один из атомов (донор), тогда как другой атом представляет только свою незаполненную орбиталь (акцептор)

В органической химии очень часто встречается водородная связь. Если атом водорода связан с сильно электроотрицательными элементами (О, N, F), то в результате существенного смещения электронной плотности к электроотрицательному элементу первый приобретает частичный положительный заряд и может электростатически взаимодействовать с обогащенным электронной плотностью центром:
–О←Н∙∙∙О–
Важным критерием отличия ковалентной связи от ионной является полярность, т.е. наличие постоянного дипольного момента. Для ковалентной связи дипольный момент мал 0,4 ÷ 1,5D.
2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
Электронная конфигурация основного состояния атома углерода 1s22s22p2, т.е. углерод должен проявлять валентность, равную двум, так как на внешнем электронном уровне находится два неспаренных (валентных) электрона. Как известно, в большинстве органических соединений углерод четырехвалентен, поскольку в процессе образования связей атом углерода переходит в возбужденное состояние. В возбужденном состоянии валентные электроны не равноценны. Согласно экспериментальным данным в молекуле метана все четыре связи атома углерода с атомами водорода одинаковы. Противоречие между теорией и экспериментом было разрешено введением понятия гибридизация орбиталей.

Для атома углерода характерно три валентных состояния, т.е. три типа гибридизации.
В зависимости от типа гибридизации между атомами углерода могут образовываться два типа ковалентной связи: σ- и π.
σ-Связь образуется при перекрывании валентных орбиталей по прямой, соединяющей центры реагирующих атомов. В зависимости от природы атомов образующих эту связь она может быть полярной и неполярной. Полярность ковалентной σ-связи показывается стрелкой по связи в структурной формуле.
π-Связь образуется за счет двойного перекрывания р-электронных орбиталей, располагающихся на параллельных осях. π-связь в отличие от σ-связи способна поляризоваться, т.е. изменять распределение электронной плотности в момент реакции.
Таблица 2.1 - Характеристики ковалентной связи
| Тип связи | Валентный угол | Длина, нм | Энергия, кДж/моль |
| С-С (σ) С=С (σ + π) С≡С (σ + 2π) | 109о28′ 120о 180о | 0,154 0,134 0,121 |
Способность органической молекулы к тем или иным типам превращений определяется энергией связи, длиной связи, а также распределением и подвижностью электронной плотности. Распределение и подвижность электронной плотности зависит от полярности и поляризуемости связи, которые в сложных молекулах проявляются в виде эффектов: индукционного, сопряжения, сверхсопряжения.
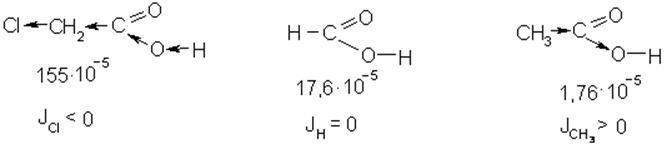
Полярность связи определяется электроотрицательностью атомов, образующих связь, т.е. способностью атомов в молекуле притягивать к себе электронную плотность. Поляризация одной какой-либо связи в сложной молекуле оказывает влияние на состояние соседних связей. Дипольный момент индуцирует в них также дипольные моменты, значительно меньшие по величине. Такой эффект называется индукционным:

Индукционный эффект сказывается на реакционной способности молекулы, но затухает по углеродной цепи к 4 – 5 углеродному атому
Способность ковалентных связей к перераспределению электронной плотности в момент реакции под влиянием различных факторов, называется поляризуемостью. В сложных молекулах поляризуемость проявляется в виде эффекта сопряжения.
Молекулы с чередующимися простыми и двойными связями обладают рядом специфических особенностей, резко отличающих их от прочих молекул. Такие соединения называются системами с сопряженными связями. Каждый из атомов сопряженной системы имеет р-электрон. Благодаря взаимодействию всех р-электронов образуется единое р-электронное облако, которое на любое внешнее воздействие отвечает как единое целое.

Проявлением эффекта сопряжения объясняется присоединение к диеновым углеводородам в положение 1,4
Эффект сопряжения (мезомерный) характерен для соединений, содержащих кратные связи или атомы с неподеленными электронными парами

Если непосредственно с ненасыщенной группой связана группа подобная метилу, то имеет место особый вид сопряжения, называемый сверхсопряжением:

Сверхсопряжение проявляется в том, что выполняется правило Марковникова.
|
Просмотров 1363 |
|
|
