
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Способы получения важнейших диенов
|
|
Способы получения углеводородов ряда дивинила в большинстве случаев не отличаются от способов получения олефинов, только соответствующие реакции необходимо проводить дважды или в качестве исходного вещества применять соединения, уже содержащие двойную связь.
Дивинил и изопрен получают в промышленности дегидрированием соответственно бутано-бутиленовых или изопентан-изоамиленовых смесей обычно над катализаторами, содержащими Cr2O3:

2. Очень большую роль в промышленном производстве дивинила сыграл метод С. В. Лебедева:
2С2Н5ОН → СН2=СН–СН=СН2 + 2Н2О + Н2 (70% от теоретического)
3. Дивинил, изопрен, диизопропенил получают дегидратацией гликолей:

4. Хлорпрен получают присоединением хлористого водорода к винилацетилену:

Физические свойства 1,3-алкадиенов
Дивинил при обычных условиях – газ. Изопрен и другие простейшие алкадиены – жидкости. Обычные закономерности, свойственные гомологическим рядам углеводородов, действуют и в этом ряду.
Для алкадиенов с сопряженными двойными связями характерны аномально высокие показатели преломления света. Благодаря этой особенности найденные молекулярные рефракции алкадиенов значительно больше вычисленных. Разница между найденной и вычисленной величинами составляет обычно 1 ÷ 1,5 единицы. Она называется молекулярной экзальтацией.
Химические особенности 1,3-алкадиенов
Две сопряженные π-связи образуют общее электронное облако – все четыре углеродных атома находятся в состоянии sp2-гибридизации (см. главу 2). Это приводит к укорочению простой связи (до 0,146 нм) и к стабилизации молекулы. Так, например, энергия образования молекулы дивинила на 14,6 кДж/моль больше по сравнению с вычисленной энергией образования углеводорода того же состава, но без учета сопряжения двойных связей. Эту разность называют энергией резонанса. Эта особенность в строении диеновых углеводородов делает их способными присоединять различные вещества не только по одной из двойных связей, но и к крайним атомам сопряженной системы – в 1,4-положения с перемещением двойной связи. Такое присоединение определяется динамическим эффектом сопряжения, т.е. перераспределением электронной плотности молекулы под влиянием атакующего агента.
Гидрирование
Каталитически возбужденный водород присоединяется в 1,2- и 1,4-положения:

Галогенирование
Галогены также способны присоединяться к сопряженным системам в 1,2- и 1,4-положения:

Как и в случае этиленовых углеводородов, присоединение может проходить как по ионному, так и по радикальному механизму.
При ионном механизме присоединения первоначально возникающий π-комплекс (I) быстро превращается в сопряженный карбониевый ион с положительным зарядом на втором и четвертом углеродных атомах. Этот ион можно изобразить или двумя граничными формулами (II) или одной формулой (III). Этот карбкатион присоединяет анион галогена с образованием продуктов 1,2- и 1,4-присоединения:

Гидрогалогенирование
В реакциях присоединения галогеноводородов действуют те же закономерности:

Гипогалогенирование
Гипогалогенитные кислоты и их эфиры присоединяются преимущественно в 1,2-положение:

Димеризация
При нагревании молекулы диеновых углеводородов способны присоединяться друг к другу таким образом, что одна из них реагирует в 1,2-, а другая в 1,4- положениях. Одновременно в небольших количествах образуется продукт, когда обе молекулы реагируют в 1,4-положениие:

Диеновый синтез
Диеновые углеводороды особенно легко димеризуются с молекулами, имеющими активированную двойную связь. Реакции этого типа называются диеновым синтезом или реакциями Дильса-Альдера:
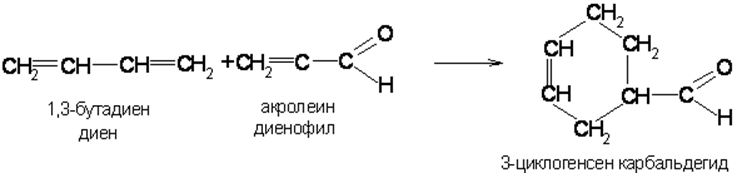
Полимеризация
Важной особенностью диеновых углеводородов с сопряженными связями является их способность полимеризоваться в каучукоподобные продукты.
Промышленный интерес представляет цепная полимеризация диеновых углеводородов под влиянием катализаторов или инициаторов. В качестве катализаторов используются щелочные металлы, металлоорганические соединения, в качестве инициаторов – органические и неорганические пероксиды.
При полимеризации отдельные молекулы мономеров могут соединяться друг с другом в 1,2-, в 1,4-положения или одна молекула реагирует в 1,2-, а другая – в 1,4- положение:

Скорость полимеризации зависит от строения диенов и условий полимеризации. Заместители в середине молекулы облегчают, а на конце молекулы затрудняют полимеризацию. Изопрен полимеризуется быстрее, а пиперилен медленнее, чем дивинил.
Наиболее ценные продукты получаются при стереорегулярной (пространственно упорядоченной) полимеризации в 1.4-положение с образованием цис-конфигурации каждого остатка:

По химическому составу и строению натуральный каучук представляет собой стереорегулярный цис-полимер изопрена.
Строение каучука и других полимеров диеновых углеводородов было доказано методом озонирования (по Гарриесу). Получение при озонолизе левулинового альдегида подтверждает упорядоченное 1,4-строение.

Различные виды синтетического и натурального каучука широко применяются в промышленности. Пионером в организации крупного промышленного производства синтетического каучука был Советский Союз.
ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ
1. Рассчитать массу (г) 1,3-бутадиена, образующегося в результате дегидрирования 20 дм3 бутана (н. у.), если выход бутадиена составляет 50%.
2. При пропускании 200 дм3 (при н. у.) паров этилового спирта над дегидратирующим и дегидрирующим катализаторами было получено 90 дм3 газообразного (при н. у.) дивинила. Определить выход реакции.
3. Рассчитайте максимальную массу (г) брома, который может присоединиться к 1,3-бутадиену, если его объем составляет 12 дм3 (условия нормальные).
4. При окислении по Гарриесу непредельного углеводорода получен ацетон, масса которого оказалась равной 29 г. Определить массу (в г) непредельного углеводорода, вступившего в реакцию, исходя из предположения, что выход продуктов озонолиза – количественный.
5. Назовите углеводород по международной номенклатуре
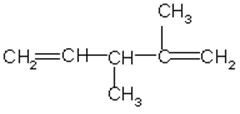
6. Написать структурную формулу 2,5-диметил-4-изопропил-1,5-гексадиена.
3.4. АЛКИНЫ: определение, изомерия, номенклатура
Алкинами называют углеводороды, содержащие кроме σ-связей две π-связи (тройную связь) у одной пары углеродных атомов. Общая формула гомологического ряда ацетиленовых углеводородов СnH2n-2. Родоначальником этого ряда является ацетилен.
Изомерия и номенклатура
Ацетиленовые углеводороды по номенклатуре ИЮПАК называют, пользуясь теми же правилами, что и в случае предельных углеводородов, но суффикс «ан» заменяется суффиксом «ин». Главная цепь выбирается так, чтобы в нее попала тройная связь, а нумеруется с того конца, к которому ближе тройная связь.
Простейшие ацетиленовые углеводороды часто называют как алкилзамещенные ацетилена, т.е. по рациональной номенклатуре:

4-метил-1-пентин 4-метил-2-пентин
Изобутилацетилен метилизопропилацетилен
Изомерия ацетиленовых углеводородов определяется как строением углеродного скелета, так и положением тройной связи.
Способы получения.
Ацетиленовые углеводороды получают либо алкилированием ацетилена, либо отщеплением галогеноводородов или галогенов от полигалогенопроизводных.
1. Ацетилен можно получить при высокотемпературном крекинге метана:

а также при гидролизе карбида кальция:
СаС2 + 2Н2О → СН≡СН + Са(ОН)2
2. Алкилирование ацетилена осуществляют, превращая ацетилен в металлоорганические соединения:
СН≡СН +NaNH2 → CH≡C–Na + NH3
ацетиленид натрия
CH≡C–Na + СH3J → CH≡C–СH3 + NaJ
пропин
3. Ацетиленовые углеводороды образуются при действии спиртовой щелочи на дигалогенопроизводные предельных углеводородов, содержащих галогены у одного или соседних атомов углерода:


Физические свойства
Основные закономерности в изменении температур кипения и плавления в гомологическом ряду ацетиленовых углеводородов сходны с закономерностями в ряду этиленовых и предельных углеводородов.
Положение тройной связи в цепи еще больше влияет на температуру кипения. Так, например, 1-бутин кипит при 8,5оС, а 2-бутин – при 27оС, тогда как оба бутана и все бутилены при обычных условиях – вещества газообразные.
Плотность и показатель преломления алкинов значительно выше, чем у алкенов и тем более алканов.
Ацетиленовые углеводороды имеют в инфракрасном спектре характерные полосы поглощения валентных колебаний тройной связи при 4,75 – 4,2 мкм (2100 – 2300 см–1.
Химические свойства
При рассмотрении химических свойств алкинов следует учитывать особенности тройной связи: по сравнению с алкенами алкины несколько менее активны в реакциях электрофильного присоединения и более активны в реакциях с нуклеофилами (вода, алкоголяты, амины). Эти особенности ацетиленовой группировки объясняются ее строением. Оба углеродных атома в ацетилене находятся в sp-гибридном состоянии. Между тем, чем больше доля s-орбитали в гибридном состоянии, тем ближе электроны находятся к ядру и, следовательно, тем труднее эти электроны вовлекаются в химические превращения с участием электрофилов. С другой стороны, ядра углерода в ацетилене гораздо более доступны для нуклеофильных реагентов благодаря его линейному строению:

Этот же фактор обусловливает и значительную СН-кислотность концевой ацетиленовой группировки. Электронная пара С-Н связи в молекуле ацетилена ближе к ядру, чем в случае этилена, и атом водорода более положительно поляризован.
Гидрирование
Водород присоединяется по месту тройной связи в присутствии тех же катализаторов, что и по месту двойной связи:

Галогенирование
Присоединение галогенов (хлора, брома, йода) к алкинам по электрофильному механизму также идет с меньшей скоростью, чем к олефинам. Образующиеся при этом непредельные дигалогенопроизводные можно выделить из реакционной смеси:

Гидрогалогенирование
Присоединение галогеноводородов к алкинам приводит к смеси этиленовых моногалогенозамещенных и предельных дигалогенозамещенных углеводородов:

Реакции присоединения галогенов и галогеноводородов к алкинам могут проходить по механизму электрофильного или радикального присоединения. При электрофильном присоединении соблюдается правило Марковникова, при радикальном механизме наблюдается противоположное направление присоединения.
Гидратация
Алкины легко присоединяют воду и кислоты в отличие от алкенов. Присоединение воды ведут в присутствии сульфата ртути – реакция Кучерова. При этом из ацетилена получается уксусный альдегид, а из его гомологов – кетоны:

Реакцию ацетилена с водой используют в промышленности для получения уксусного альдегида. Возможный механизм реакции Кучерова:

Присоединение спиртов
Спирты присоединяются к алкинам в присутствии алкоголятов. Этим способом получают виниловые эфиры, а также ацетали:

Присоединение спиртов в присутствии алкоголятов – это типичная реакция нуклеофильного присоединения. Ее механизм можно представить следующим образом:

|
Просмотров 2875 |
|
|
