
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Изомерия и номенклатура ароматических углеводородов
|
|
Простейшим представителем ароматических соединений является бензол. Ближайший гомолог бензола – толуол, также не имеет изомеров. Следующий гомолог имеет четыре изомера
Изомерия ароматических углеводородов гомологического ряда бензола связана:
1) с изомерией положения радикалов;
2) с изомерией радикалов.

бензол толуол о-ксилол м-ксилол п-ксилол этилбензол
Два радикала могут занимать в ядре три положения, носящие название орто (1,2)-, мета (1,3)-, и пара (1,4)-.
Из более сложных углеводородов тривиальные названия сохранили:

кумол цимол
изопропилбензол 1-метил-4-изопропилбензол
Для ароматических соединений используется и систематическая номенклатура (ИЮПАК). По этой номенклатуре все соединения рассматриваются как производные бензола и цифрами указываются положения заместителей.
Способы получения
Ароматические углеводороды ряда бензола содержатся в некоторых сортах нефти. Помимо этого, так как ядро бензола энергетически очень «выгодная» система, соединения ароматического ряда образуются при многих процессах. Так, например, при каталитическом и термическом крекинге нефти они образуются в заметных количествах. При переработке каменного угля в кокс в каменноугольной смоле содержание ароматических соединений достигает нескольких десятков процентов (бензол, толуол, ксилолы, фенол, нафталин, антрацен).
В лабораторной практике и в промышленности для синтеза аренов применимы следующие способы:
1. Ароматизация парафинов на оксиде хрома

2. Ацетилен и его гомологи при температуре красного каления, а в присутствии катализаторов и при более низкой температуре образуют ароматические углеводороды

Мезитилен
3. Дегидрирование циклоалканов, содержащих шестичленное кольцо

циклогексан циклогексен циклогексадиен бензол
4. Сплавление солей бензойной кислоты со щелочами

5. Гомологи бензола можно получить:
а) из галогенопроизводных реакцией Вюрца-Фиттига
 хлорбензол хлорметан толуол дифенил этан
хлорбензол хлорметан толуол дифенил этан
б) реакцией Фриделя-Крафтса

В качестве катализатора в реакции Фриделя-Крафтса используют безводные хлориды тяжелых металлов и алюминия, а также фтористый водород.
в) восстановлением ароматических кетонов амальгамированным цинком в соляной кислоте:

хлористый ацетил ацетофенон этилбензол
Физические свойства
Ароматические углеводороды – обычно жидкости и реже твердые вещества – обладают сильным специфическим запахом. Температура кипения ароматических углеводородов выше, чем соответствующих алканов.
Изомеры с несколькими радикалами кипят при более высокой температуре, чем изомеры с одним радикалом. При сближении радикалов температура кипения обычно возрастает.
Каждая новая группа СН2 повышает температуру кипения примерно на 30 оС.
Плотность и показатели преломления ароматических углеводородов значительно выше, чем у углеводородов алифатического и алициклического рядов.
Ароматические углеводороды почти нерастворимы в воде. Вдыхание их паров вызывает отравление. Обладают канцерогенностью.
Химические свойства
Ароматические углеводороды обладают большей склонностью к реакциям замещения, чем к реакциям присоединения. Характерна также большая устойчивость бензольного кольца к окислителям.
Реакции присоединения
Реакции присоединения протекают обычно по трем кратным связям бензольного кольца одновременно.
1. Гидрирование бензола и его гомологов происходит в присутствии катализаторов (Ni, Pt, Pd) при повышенной температуре:

2. Если раствор хлора или брома в бензоле подвергнуть действию солнечного света или ультрафиолетовых лучей, то происходит быстрое присоединение трех молекул галогена. Продукты присоединения при нагревании теряют три молекулы галогеноводорода и дают тригалогенбензол:

3. Бензол и его гомологи присоединяют озон с образованием чрезвычайно взрывоопасных триозонидов, которые разлагаются на карбонильные соединения под действие воды. Эта реакция используется для доказательства строения ароматических соединений:

Реакции окисления
Бензольное кольцо устойчиво к действию окислителей. Такие окислители как перманганат калия, оксид хрома (+6), азотная кислота на бензол не действуют.
1. При окислении бензола кислородом воздуха на оксиде ванадия (+5) образуется малеиновый ангидрид:

малеиновый ангидрид
2. При окислении гомологов бензола кислородом воздуха образуются гидропероксиды. В реакции принимает участие углеродный атом в α-положении к бензольному кольцу:

кумол гидроперекись кумола
3. При действии окислителей на гомологи бензола окисляется боковая цепь. Независимо от длины боковой цепи она дает карбоксильную группу:
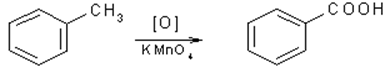
толуол бензойная кислота
Следует отметить, что третичные алкильные группы, связанные с бензольным кольцом, устойчивы к окислению; бензольное кольцо окисляется легче, чем эти группы.
Реакции замещения
1. В присутствии катализаторов (FeCl3, AlCl3) хлор и бром не присоединяются к бензолу, но замещают атомы водорода в его молекуле:

бромбензол
2. Концентрированная серная кислота не вызывает полимеризации бензола, как это происходит в случае алкенов и алкадиенов, а приводит к образованию бензолсульфокислоты:

Бензолсульфокислота
3. При действии нитрующей смеси (концентрированная азотная и серная кислоты) происходит нитрование ядра:

нитробензол
Механизм этих реакций электрофильный. Он осуществляется и при протекании реакций алкилирования, ацилирования, азосочетания.
Механизм электрофильного замещения в бензольном кольце разберем на примере реакции галогенирования.
Под действием катализатора образуется активная форма электрофильного реагента:

Стадией, определяющей скорость реакции, является образование σ-комплекса:
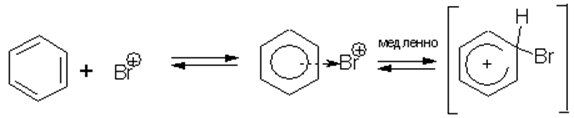
π-комплекс σ-комплекс
π-Комплекс – это промежуточное состояние, в котором реагирующие частицы сориентировались относительно друг друга.
σ-Комплекс – это катион, лишенный ароматической структуры, с четырьмя π-электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Шестой углеродный атом при образовании σ-комплекса переходит из состояния sp2 в состояние sp3-гибридизации, приобретая таким образом тетраэдрическую симметрию.
σ-Комплекс – это не переходное состояние, а настоящее промежуточное соединение.
На следующей стадии лабильный σ-комплекс превращается в стабильный замещенный бензол с потерей протона:

Н+ + AlBr4– → AlBr3 + HBr
|
Просмотров 2712 |
|
|
