
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Сульфирование, сульфоокисление, сульфохлорирование
|
|
Дымящаяся серная кислота с высшими парафинами дает сульфокислоты:

2-сульфокислота
Однако для получения сульфопроизводных чаще используют реакции сульфоокисления и сульфохлорирования:

3-метил-2-сульфобутан

3-метил-2-хлорсульфонилбутан
Все эти реакции протекают по радикальному механизму. Особенностью этих реакций является тот факт, что при наличии в молекуле первичных, вторичных и третичных атомов углерода замещению не подвергаются атомы водорода при третичном углеродном атоме. Причиной такой особенности реакции является пространственная затрудненность подхода объемистого реагента к третичному атому углерода.
Окисление
Окислители, даже сильные, при обычных температурах не действуют на предельные углеводороды.
При температуре выше 300оС предельные углеводороды воспламеняются и сгорают с образованием СО2 и Н2О.
При температуре около 200оС эти углеводороды окисляются кислородом воздуха в присутствии марганцевых катализаторов, образуя кислородсодержащие вещества с меньшим числом атомов углерода в молекуле, т.е. окисление сопровождается расщеплением молекул углеводородов. Окисление алканов также имеет радикальный механизм, а промежуточными продуктами являются гидроперекиси:
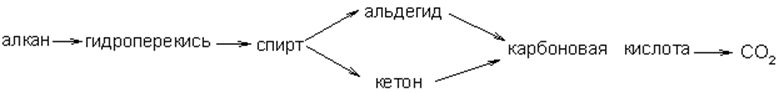
При очень высоких температурах в промышленности реализован процесс взаимодействия метана с водой
СН4 + Н2О → СО + 3Н2
Получающаяся смесь газов идет на синтез синтина или метанола.
Крекинг углеводородов при высоких температурах
Основные процессы при крекинге – дегидрогенизация углеводорода и разрыв углеродной цепи. Одновременно происходит изомеризация и циклизация. Промежуточными продуктами во всех этих процессах являются свободные алифатические радикалы.
Продолжительность жизни свободных алифатических радикалов измеряется тысячными долями секунды, т.е. она значительно меньше продолжительности жизни атомарного водорода (0,1 с).
Свободные радикалы способны к следующим основным химическим превращениям:
1. Захват атома водорода с превращением в углеводород и передачей цепи:
СН3• + СН3-СН3 → СН4 + СН3–СН2•
2. Распад по β-связи:
R-CH2-CH2• → R• + CH2=CH2
3. Диспропорционирование:

4. Соединение
2R-CH2• → R-CH2-CH2-R
Метильные радикалы образуют метан, этан, этилен, водород. Этил дает этилен, этан, бутан, водород.
В технике крекинг играет исключительную роль в переработке нефтяного сырья.
Задачи для самопроверки
1. Рассчитать массу алкана (в г), полученного при взаимодействии 10 г бромистого пропила с металлическим натрием, если выход продукта составляет 60%.
2. Сколько монохлорзамещенных углеводородов можно получить хлорированием 2,3-диметилбутана?
3. Сколько моль кислорода потребуется для сжигания 1 моль гептана?
4. Определить объем (дм3) диоксида углерода, образовавшегося при взрыве смеси 5 дм3 метана и 11 дм3 кислорода.
5. Сколько мононитрозамещенных углеводородов можно получить при нитровании по Коновалову 2,3-диметилбутана?
6. Рассчитать объем (дм3) газа (н. у.), полученного при прокаливании 6 г ацетата натрия с избытком гидроксида натрия, если выход продукта составляет 50%.
3.2 АЛКЕНЫ: определение, изомерия, номенклатура
Углеводороды, в молекулах которых помимо одинарных углерод-углеродных σ-связей имеются углерод-углеродные π-связи, называются непредельными.
Углеводороды, содержащие одну углерод-углеродную π-связь (то есть двойную связь), называются алкенами или олефинами. Общая формула членов гомологического ряда этиленовых углеводородов СnH2n. Родоначальник ряда − этилен СН2=СН2.
Изомерия и номенклатура
В соответствии с правилами ИЮПАК при построении названий алкенов наиболее длинная углеродная цепь, содержащая двойную связь, получает название соответствующего алкана, в котором суффикс «ан» заменен на «ен». Эта цепь нумеруется таким образом, чтобы углеродные атомы, участвующие в образовании двойной связи, получили номера, наименьшие из возможных. Радикалы называются и нумеруются, как и в случае алканов:
 5-метил-2-гексен
5-метил-2-гексен
Углеводородные радикалы, образованные из алкенов, получают суффикс –енил, в общем случае –алкенил. Нумерация в сложных радикалах начинается от углеродного атома, имеющего свободную валентность. Для простейших радикалов используются тривиальные названия:
 этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил
этенил 2-пропенил 1-метилэтенил 2-метил-2-бутенил
(винил) (аллил) (изоаллил)
Структурная изомерия начинается в этом ряду, как и в ряду предельных углеводородов, с члена ряда С4, однако число изомеров значительно больше. Наряду с изомерией, связанной со строением углеродной цепи, в ряду олефинов наблюдается структурная изомерия, обусловленная положением двойной связи в цепи.
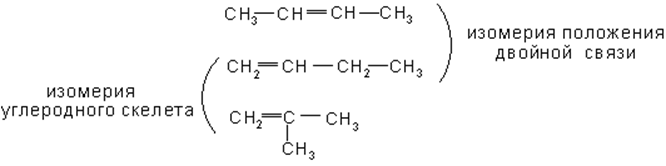
Кроме того, в ряду олефинов имеет место пространственная (геометрическая), так называемая цис-, транс- изомерия (E, Z).
Вращение вокруг связи С─С в молекулах алканов требует малой затраты энергии (8-16 кДж/моль). Для этого достаточно теплового движения молекул.
Вращение же фрагментов С=С относительно друг друга требует разрыва π-связи и затраты 272 кДж/моль. В связи с этим соединения, содержащие у атомов углерода, связанных двойной связью, хотя бы по одному разному заместителю, могут существовать в изомерных формах. Эти изомеры различаются пространственным расположением заместителей относительно друг друга. Если заместители расположены по одну сторону от двойной связи, то такой изомер называется цис-изомером, и транс-изомером, если по разные стороны:

(Z) цис-2-бутен (Е) транс-2-бутен
В сложных молекулах понятие цис- и транс- становятся неопределенными. В этих случаях пользуются общей ZЕ-системой обозначений. Составлена таблица возрастающего старшинства групп. Если старшая группа у одного из углеродных атомов находится по одну сторону со старшей группой у другого атома углерода, то этот изомер называется Z-изомером.
Способы получения
Олефины встречаются в некоторых сортах нефти. В чистом виде из нефти выделены углеводороды от С6Н12 до С13Н26. Алкены, в виде сложных смесей получаются при крекинге нефти.
В технике, кроме того, применяется получение этиленовых углеводородов дегидрированием предельных углеводородов. Катализатором этого процесса служит окись хрома:
 В лаборатории этиленовые углеводороды получают следующими способами:
В лаборатории этиленовые углеводороды получают следующими способами:
1. При действии спиртовых растворов едких щелочей на галогенопроизводные отщепляется галогеноводород и образуется двойная связь. Порядок отщепления галогеноводорода в большинстве случаев определяется правилом Зайцева: при образовании галогеноводорода и воды наиболее легко отщепляется водород от наименее гидрогенизированного соседнего атома углерода:

2-метил-3-хлорбутан 2-метил-2-бутен
2. При действии на спирт дегидратирующих средств:


этилен
3. При действии Zn или Mg на дигалогенопроизводные с двумя атомами галогена у соседних атомов углерода (вицинальные дигалогенопроизводные):

2,3-дибромбутан 2-бутен
4. Гидрированием ацетиленовых или диеновых углеводородов. Алкины гидрируются над катализаторами с пониженной активностью (Fe или платина и Рd, «отравленные» серой, Na в аммиаке):

пропин пропен

1,3-бутадиен 2-бутен
Физические свойства
Физические свойства алкенов подобны свойствам соответствующих алканов. Низшие алкены (С2 – С4 ) являются газами, средние алкены (начиная с С5 до С17) жидкостями, не смешивающиеся с водой. Высшие алкены – твердые вещества.
Олефины с нормальной цепью углеродных атомов кипят при более высокой температуре, чем их изомеры с разветвленной цепью. Перемещение двойной связи в центр молекулы вызывает повышение температуры кипения и плавления алкена. Цис-изомеры обычно кипят при более высокой, а плавятся при более низкой температуре, чем транс-изомеры.
Плотность олефинов меньше единицы, но больше, чем плотность соответствующих парафинов. В гомологическом ряду она увеличивается. Для олефинов характерны более высокие показатели преломления света, чем для парафинов.
Следует заметить, что этиленовые углеводороды хорошо растворяются в растворах некоторых солей тяжелых металлов (Сu2Cl2), образуя с ними комплексные соединения.
Химические свойства
Главным структурным элементом, определяющим реакционную способность алкенов, является двойная связь, представляющая собой сочетание σ- и π-связей (sp2-гибридизация). При сравнении структурных и энергетических параметров молекул алканов и алкенов видно, что двойная связь значительно короче и прочнее одинарной связи. Однако энергия двойной связи меньше, чем энергия двух ординарных, на 92,1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
Таким образом, для олефинов наиболее типичны реакции присоединения. Однако следует иметь в виду, что олефины способны и к реакциям замещения, причем некоторые из них идут значительно легче, чем у парафинов (наиболее легко замещается водород у α-углеродного атома по отношению к двойной связи благодаря σ,π-сопряжению (сверхсопряжению). При разрыве таких СН-связей образуется радикал, стабилизированный сопряжением (см. главу 2).
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерны реакции электрофильного присоединения (АЕ).
Гидрирование
Присоединение водорода к алкенам происходит только в присутствии катализаторов, как гетерогенных (Pt, Pd, Ni) так и гомогенных. Наиболее часто проводят каталитическое гидрирование на гетерогенных катализаторах:

этилен этан
Галогенирование
Олефины легко присоединяют галогены. Скорость реакции зависит от природы галогена и строения алкена. Фтор реагирует с воспламенением, иод – медленно на солнечном свету:

1,2-дибромэтан
Галогены могут присоединяться к олефинам по радикальному или ионному механизму.
При радикальном присоединении атома галогена, присоединение начинается к наиболее доступному из атомов углерода с образованием наиболее стабильного из возможных радикалов:

пропен 1,2-дибромпропан

Чаще происходит присоединение по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделятся отрицательный ион галогена. К возникшему карбониевому или бромониевому катиону присоединяется отрицательный ион галогена:

Реакция олефинов с галогенами служит для качественного и количественного определения их в смеси.
|
Просмотров 3684 |
|
|
