
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Опыт № 1. Растворимость в воде и отношение к индикаторам. Муравьиную, уксусную кислоты (по 3 капли) и несколько кристалликов трихлоруксусной и стеариновой кислот помещают в четыре пробирки (каждое вещество помещают в
|
|
Муравьиную, уксусную кислоты (по 3 капли) и несколько кристалликов трихлоруксусной и стеариновой кислот помещают в четыре пробирки (каждое вещество помещают в отдельную пробирку), добавляют по 5 капель воды и встряхивают. Что наблюдается? Содержимое пробирок нагревают, затем охлаждают. Отмечают происходящие изменения. В пробирки помещают полоски универсального индикатора и отмечают изменение цвета.
Опыт № 2. Кислотные свойства карбоновых кислот.
а) В пробирку помещают 3 капли уксусной кислоты, 2 капли воды и добавляют несколько крупинок карбоната натрия. Пробирку закрывают пальцем. Что наблюдается? К отверстию пробирки подносят горящую спичку и убирают палец. Что наблюдается?
б) В пробирку помещают 3 капли уксусной кислоты, 2 капли воды и добавляют немного магния. Пробирку закрывают пальцем. Что наблюдается? К отверстию пробирки подносят горящую спичку и убирают палец. Что наблюдается
Опыт № 3. Получение этилацетата (этилового эфира уксусной кислоты).
В сухую пробирку помещают немного (высота слоя около 2 мм) безводного ацетата натрия и 3 капли этилового спирта. Добавляют 2 капли концентрированной серной кислоты и осторожно нагревают над пламенем спиртовки. Отмечают изменение запаха.
Опыт № 4. Получение ацетанилида.
В пробирку помещают 1-2 капли анилина, 3 капли воды и 1 каплю уксусного ангидрида. Содержимое пробирки тщательно перемешивают и подогревают на водяной бане 1-2 минуты. Затем охлаждают. Что наблюдается?
Опыт № 5. Получение и свойства высших карбоновых кислот.
а) В пробирку помещают 6-7 капель концентрированного раствора мыла, добавляют 1 каплю серной кислоты и слегка подогревают на водяной бане. Что наблюдается? Содержимое пробирки оставляют для следующего опыта.
б) В пробирку с жирными кислотами, полученными в предыдущем опыте, добавляют 2-3 капли бромной воды и пробирку встряхивают. Отмечают происходящие изменения.
в) В пробирку помещают 2-4 капли концентрированного раствора мыла, добавляют 1-2 капли раствора хлорида кальция и встряхивают. Отмечают происходящие изменения.
Отчет по работе должен содержать следующие данные:
1. Название лабораторной работы.
2. Цель работы.
3. Описание опытов, уравнения всех проводимых реакций.
4. Таблицу с результатами опыта № 1.
5. План проведения анализа неизвестного вещества.
6. Описание и результаты проведенного анализа.
7. Вывод по проделанной работе.
Часть 2. Амины и аминокислоты
Цель работы:знакомство с реакциями аминов и аминокислот.
Краткая теория
Амины.
Аминами называются производные аммиака, в которых один, два или все три атома водорода замещены на углеводородные радикалы. Амины могут быть первичными - RNH2, вторичными - R2NH и третичными – R3N.
При выполнении работы следует помнить следующее:
1. Химические свойства аминов определяются наличием неподеленной электронной пары у атома азота. Эта пара электронов обуславливает то, что амины являются основаниями (акцепторами протонов), а также выступают в роли нуклеофилов. Основные свойства аминов зависят от количества и строения радикалов, связанных с азотом. Электронодонорные заместители усиливают основность аминов, так как увеличивают электронную плотность на атоме азота. Растворимые в воде алифатические амины образуют гидроксиды алкиламмония:



 R2NH + H2O (R2NH2)OH R2NH2+ + OH-
R2NH + H2O (R2NH2)OH R2NH2+ + OH-
2. В ароматических аминах неподеленная пара электронов атома азота участвует в сопряжении с ароматическим ядром и становится менее склонной к образованию связи с протоном. Поэтому ароматические амины являются более слабыми основаниями и образуют соли только с достаточно сильными кислотами:
 ArNH2 + H+ ArNH3+
ArNH2 + H+ ArNH3+
3. Как нуклеофилы амины вступают в реакции алкилирования и ацилирования. При взаимодействии с азотистой кислотой в кислой среде первичные амины образуют диазониевые соли:
HX
 RNH2 + HNO2 (R-N=N)+ X-
RNH2 + HNO2 (R-N=N)+ X-
4. Соли диазония алифатических аминов очень неустойчивы и сразу разлагаются с выделением азота, поэтому продуктами реакции диазотирования первичных алифатических аминов являются спирты:
HX H2O

 AlkNH2 + HNO2 (Alk-N=N)+ X- AlkOH + N2 + HX
AlkNH2 + HNO2 (Alk-N=N)+ X- AlkOH + N2 + HX
5. Соли диазония ароматических аминов более устойчивы и могут реагировать без выделения азота. При их взаимодействии с фенолами или ароматическими аминами (реакция азосочетания) образуются окрашенные соединения. Реакция азосочетания является качественной реакцией на первичные ароматические амины.
Ar,OH
 (Ar-N=N)X Ar-N=N-Ar,OH-п
(Ar-N=N)X Ar-N=N-Ar,OH-п
Аминокислоты
Аминокислоты - органические соединения, которые содержат две функциональные группы, противоположные по характеру: кислую карбоксильную и основную аминогруппу. Это создает возможность образования внутренних солей – бетаинов: +NH3(CH2)nCOO-.
1. Аминокислоты вступают в реакции по карбоксильной группе – этерификация, солеобразование. С основаниями образуют обычные соли, а с ионами тяжелых металлов комплексные соли:

 O=C-O NH2-CH2
O=C-O NH2-CH2
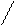
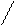

 Cu
Cu
CH2-NH2 O-C=O
2. Аминокислоты также дают все реакции аминов: образуют соли с кислотами, алкилируются, ацилируются, вступают в реакции конденсации с карбонильными соединениями. При реакции аминокислот, содержащих первичную алифатическую аминогруппу, с азотистой кислотой происходит диазотирование и распад соли диазония с образованием гидроксикислоты:
H2O





 R-CH-COO- + HNO2 (R-CH-COO-) R-CH-COOH
R-CH-COO- + HNO2 (R-CH-COO-) R-CH-COOH
+NH3 N2+ -N2 OH
Эта реакция используется для качественного определения a-аминокислот в растворе.
3. Кроме реакций по амино- и карбоксильной группам аминокислоты могут вступать в реакции и за счет радикалов. Например, аминокислоты, которые содержат ароматические кольца, нитруются концентрированной азотной кислотой.
Экспериментальная часть
Студент получает набор известных веществ (амины – метиламин, анилин, сульфаниловую кислоту и набор аминокислот) и изучает их химические свойства.
Последовательность выполнения работы:
1. Проводятся реакции аминов и аминокислот, отмечаются условия проведения реакций и все видимые изменения. Данные опытов № 1 и № 5 сводятся в таблицу.
|
Просмотров 1462 |
|
|
