
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Полисахариды – высокомолекулярные несахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (обычно гексоз), связанных гликозидными связями
|
|
Важнейшие природные представители: крахмал, гликоген, целлюлоза. Это природные полимеры (ВМС), мономером которых является глюкоза. Их общая эмпирическая формула (C6H10O5)n.
Крахмал – амфорный порошок белого цвета, без вкуса и запаха, плохо растворяется в воде, в горячей воде образует коллоидный раствор. Макромолекулы построены из большого числа остатков α-глюкозы. Состоит из двух фракций: амилазы (20-30%) и амилопектина (70-80%).
Молекулы амилозы – это очень длинные неразветвленные цепи, состоящие из остатков α-глюкозы (1,4-гликозидная связь). Относительная молекулярная масса молекул амилозы колеблется от 60 до 500 тысяч. Но молекулы имеют очень компактное строение, так как закручены в спираль, на виток спирали приходится 6-7 остатков α-глюкозы.
Молекулы амилопектина в отличие от молекул амилозы сильной разветвлены. Подавляющее большинство глюкозных остатков в амилопектине связаны, как в амилозе α-гликозидными связями. Однако в точках разветвлений цепи имеют α-1,6-гликозидные связи. Число глюкозных остатков в молекулах амилопектина значительно выше, относительная молекулярная масса колеблется от 100 000 до 1 млн. Молекулы амилопектина тоже довольно компактны, так как имеют сферическую форму.
Химические свойства крахмала:
I. Гидролиз крахмала – идет ступенчато, схематически его можно изобразить так:
(C6H10O5)n + H2O  (C6H10O5)x + H2O
(C6H10O5)x + H2O  C12H22O11 + H2O
C12H22O11 + H2O  nC6H12O6
nC6H12O6
крахмал декстрины мальтоза глюкоза
В 1811 году русский ученый К.Кирхгоф открыл реакцию гидролиза крахмала под действием HCl.
II. Качественная реакция на крахмал:
(С6Н10О5)n + I2 → комплексное соединение сине-фиолетового цвета.
При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3 и 6 атомов углерода), в точках разветвлений – у 2 и 3 атомов углерода. Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров (качественную реакцию на многоатомные спирты не дает, так как плохо растворяется в воде).
Биологическая роль крахмала. Гликоген.
Крахмал – один из продуктов фотосинтеза, главное запасное питательное вещество растений. Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в тоже время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Гликоген – это эквивалент крахмала, синтезируемый в животном организме, т.е. это тоже резервный полисахарид, молекулы которого построены из большого числа α-глюкозы. Содержится в основном в печени и мышцах. По своему строению он очень близок к амилопектину. Отличия:
1. содержит большое число остатков α-глюкозы, относительная молекулярная масса колеблется от 1 до 15 млн.;
2. молекулы гликогена более разветвленные и вследствие этого более плотные.
Гликоген – белый амфорный порошок, хорошо растворимый даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Целлюлоза (клетчатка) – главная составная часть растительной клетки, синтезируется в растениях (в древесине до 60% целлюлозы). Чистая целлюлоза – более волокнистое вещество, без вкуса и запаха, нерастворимое в воде. Молекулы целлюлозы – это длинные цепи, состоящие из остатков β-глюкозы, которые соединяются за счет образования β-1,4-гликозидных связей.
Различие в строении и свойствах крахмала и целлюлозы:
1. содержат остатки разных форм циклической глюкозы;
2. содержат разное число структурных звеньев – остатков глюкозы;
3. между остатками глюкозы образуются различные связи;
4. макромолекулы имеют различную структуру:
- крахмал разветвленные и неразветвленные молекулы;
- целлюлоза – только неравзветвленные, имеют вид нитей, так как форма остатков β-глюкозы исключает спирализацию.
5. крахмал – продукт питания, так как в организмах человека и животных есть ферменты, расщепляющие α-1,4- и α-1,6-гликозидные связи;
6. целлюлоза не является продуктом питания человека и большинства животных, так как в их организмах нет ферментов, расщепляющих более прочные β-1,4-гликозидные связи.
7. жвачные животные и кролики способны усваивать целлюлозу посредством содержащихся в их организме бактерий.
Химические свойства целлюлозы:
1. гидролиз целлюлозы – до β-глюкозы;
2. образование сложных эфиров (за счет трех свободных гидроксилов):
- нитрование с образованием тринитрата целлюлозы (кат. HCl);
- с органическими кислотами, например, с уксусной – триацетат целлюлозы.
3. горение – полное окисление;
4. термические разложение целлюлозы без доступа воздуха, с образованием древесного угля, воды, летучих органических веществ.
6. Пространственное строение органических соединений. Таутомерия. Оптическая активность.
Подобно любым другим физическим телам, молекулы органических соединений занимают в пространстве определенный объем, имеют определенную форму. Молекулы, имеющие при одинаковом строении разную пространственную форму, являются пространственными изомерами. Известны несколько видов пространственной изомерии (стетеоризомеры):
- поворотная изомерия (конформация);
- цис-транс-изомерия;
- оптическая изомерия;
- таутомерия.
Стереоизомерами, или пространственными изомерами, называются изомеры, имеющие одинаковое строение, но отличающиеся расположением атомов в пространстве. Стереоизомеры делятся на конформационные и конфигурационные.
Конформационные изомеры могут быть заслоненные и заторможенные, зигзагообразные и клешневидные.
Конфигурационные – это изомеры, отличающиеся расположением атомов и групп атомов в пространстве (без учета конформаций).
Конформационные стереоизомеры могут превращаться друг в друга за счет вращения вокруг σ-связей. Конфигурационные стереоизомеры не способны превращаться друг в друга без разрыва химических связей. Конфигурационные стереоизомеры подразделяются на два основных типа – энантиомеры и диастереомеры.
Энантиомеры – это стереоизомеры, относящиеся друг к другу как предмет и несовместимое с ним зеркальное изображение.
В виде энантиомеров могут существовать только хиральные молекулы.
Хиральность – это свойство объекта быть несовместимым со своим зеркальным изображением (правая и левая руки). Для хиральных молекул характерно наличие одного или более центров хиральности. В качестве центра хиральности чаще всего выступает асимметрический атом углерода.
Асимметрическим называется атом углерода, связанный с четырьмя различными заместителями.
Более ста лет назад стало известно явление оптической активности некоторых органических веществ – способность вращать плоскость поляризации света. При пропускании света через некоторые кристаллы (турмалин, исландский шпат) он становится поляризованным: это значит, что его электромагнитная волна колеблется в одной плоскости, называемой плоскостью поляризации. Во вращении этой плоскости и проявляется оптическая активность. Измеряется оптическое вращение с помощью приборов, называемых поляриметрами.
Энантиомеры обладают одинаковыми физическими и химическими свойствами (температуры плавления и кипения, плотность, растворимость и т.д.). Они отличаются только знаком вращения плоскости поляризации. При прохождении поляризованного света через раствор одного энантиомера происходит отклонение плоскости поляризации влево, другого – вправо на тот же по величине угол α.
Оптической активностью обладают многие природные органические вещества: белки, сахара, нуклеиновые кислоты, алкалоиды.
Изучение оптической изомерии и связанного с ней пространственного строения молекул имеет большое значение для биохимии. Оказывается, например, что оптические антиподы по разному воздействуют на организмы, т.е. различаются по своему физиологическому действию. Так, содержащийся в табаке правовращающий никотин в несколько раз ядовитее своего левовращающего энантиомера.
Каждое соединение, существующее в виде двух оптически активных энантиомеров, может иметь и третью, оптически неактивную форму, называемую рацематом.
Рацематом называется равномолекулярная смесь двух энантиомеров, где левое вращение одного энантиомера полностью компенсируется правым вращением другого.
Относительная и абсолютная конфигурации.
Для изображения конфигурационных стереоизомеров на плоскости можно пользоваться стереохимическими формулами, а также используют проекционные формулы. Для удобства в стереохимии в качестве конфигурационного стандарта используют проекционную формулу глицеринового альдегида. В 1906 году М.А.Розановым левовращающему глицериновому альдегиду была приписана формула, где карбонильный кислород и гидроксогруппа находились по разные стороны (обозначили буквой L). Правовращающий энантиомер обозначили буквой D.
Два энантиомера глицеринового альдегида были приняты в качестве родоначальника D- и L-стереохимических рядов. Отсюда отнесение других оптически активных соединений к D- или L-стереохимическому ряду производится путем сравнения конфигурации их асимметрического атома с конфигурацией D- и L-глицеринового альдегида. Путем такого сравнения определяют относительную конфигурацию.
С развитием физико-химических методов анализа стало возможным определение абсолютной (истинной) конфигурации энантиомеров. Очень важен тот факт, что определенные относительные конфигурации совпали с абсолютными.
Диастереомеры.
В молекулах многих органических соединений содержится два и более асимметричных атома углерода. При этом возрастает число конфигурационных стереоизомеров, которое вычисляется по формуле 2n, где n – число асимметрических атомов углерода.
Диастереомерами называются стереоизомеры, не относящиеся друг к другу как предмет и несовместимое с ним зеркальное изображение.
Диастереомерты различаются по своим физическим и химическим свойствам.
Таким образом, изомерия проявляется не только у соединений, имеющих одинаковый состав, но разное строение (структурная изомерия), но и у соединений с одинаковым составом и строением. В последнем случае отличительной чертой является различное пространственное расположение атомов (стереоизомерия).
7. Дополнительный материал по теме: «Углеводы».
Общая формула Cn(H2O)m (формально – «гидраты углерода»). Выделяют три самостоятельных класса: моносахариды, олигосахароиды и полисахариды.
Моносахариды – это гетерофункциональные соединения, содержащие оксогруппу и несколько гидроксильных групп, т.е. полигидроксиальдегиды и полигидроксикетоны.
| суффикс –ОЗА | |
| | |
В зависимости от длины углеродной цепи – триозы, тетрозы, пентозы, гексоза и т.д. Наиболее распространены пентозы и гексозы.
| альдегидная | oксогруппа | кетонная | |||||||||||
OH–CH2
|
OH–CH
|
OH–CH
|
OH–CH
|
C=O
|
|
| OH–CH2 | OH–CH | OH–CH | OH–CH | OH–CH | С=O | H |
| OH–CH2 | OH–CH | OH–CH | О=С | OH–CH2 |
| OH–CH2 | OH–CH | OH–CH | OH–CH | О=С | OH–CH2 | |||||||
Стереоизомерия.
Моносахариды содержат несколько центров хиральности (асимметрических атомов С), поэтому одной и той же структурной формуле соответствует несколько стереоизомеров, например, в альдопентозе – 3 центра, существует 8 (2n, где n=3) стереоизомеров. У альдогексоз будет уже 16 стереоизомеров.
D и L – стереохимические ряды проводят по конфигурации хирального центра, наиболее удаленного от оксогруппы, независимо от конфигурации остальных центров. Для пентоз – С-4, гексоз – С-5.
Следует помнить, что символы D и L никак не связанны с вращением плоскости поляризованного света вправо или влево, которое обозначается знаками (+) или (-) и определяется экспериментально. Эти особенности строения хорошо видны на проекционных формулах Фишера – расположение –OH группы определяющего хирального центра слева от альдегидной группы – L-ряд, справа – D-ряд.
| O || C–H | CH–OH | CH–OH | HO–C–H | CH2–OH L-альдопентоза | CH2–OH | C=O | CH–OH | CH–OH | H–C–OH | CH2–OH D-кетогексоза | O || C–H | H–C–OH | H–C–OH | H–C–OH | CH2–OH D-рибоза | CH2–OH | C=O | HО–С–OH | H–C–OH | H–C–OH | CH2–OH D-фруктоза | O || C–H | H–C–OH | HО–C–H | HО–C–H | H–C–OH | CH2–OH D-галактоза |
Наряду с моносахаридами с открытой цепью существуют циклические формы (в равновесии). Возможность циклизации моносахаридов обусловлена двумя факторами:
1. цепи из пяти и более атомов С могут принимать клешневидную конформацию, при этом сближаются карбонильная и гидроксильная группы при С-5 или С-4;
2. взаимодействие –ОН и С=О, приводящее к полуацетаям протекает внутримолекулярно.
Если в образовании циклической формы принимает участие –ОН группа при С-5 альдоз, то образуется шестичленный цикл – пиранозный, образовавшаяся в результате циклизации полуацетальная –ОН группа называется гликозидной – определяет α и β моносахарид (С-1 аномерный центр) sp3-гибридизация.
α-глюкопираноза (α-глюкоза) пиранозный цикл
При взаимодействии оксогруппы с –ОН при С=4 замыкается пятичленный цикл – фуранозный.
β-глюкофираноза
Одновременно существуют циклическая и открытая формы моносахаридов которые находятся в динамическом (таутомерном) равновесии.
Химические свойства:
а) полуацетальный гидроксил:
α-глюкопираноза | 
|
метилглюкопиранозид (смесь α и β) |
Реакция обратима и в кислой среде дает исходные продукты.
Эта реакция только полуацетального –ОН.
б) спиртовые гидроксилы:
1. с Cu(OH)2:
| | |
глюконат меди (II) (темно-синий раствор)
2. c ангидридами, с галогенангидридами (сложные эфиры):
| | 
| |
3. с галогеналканами (простые эфиры):
| | 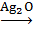
| |
в) с участием альдегидной группы:
1. восстановление:
| O || C–H | H–C–OH | OH–C–H | H–C–OH | H–C–OH | CH2–OH глюкоза | + H2 
| CH2–OH | CH–(OH)4 | CH2–OH глюцит (сорбит) |
2. окисление:
- реакция «серебряного зеркала»:
| O || C–H | H–C–OH | OH–C–H | H–C–OH | H–C–OH | CH2–OH глюкоза | + Ag2O 
| O || C–OH | H–C–OH | OH–C–H | H–C–OH | H–C–OH | CH2–OH глюконовая кислота | + Ag2↓ |
- с Cu(OH)2:
| O || C–H | H–C–OH | OH–C–H | H–C–OH | H–C–OH | CH2–OH глюкоза | + 2Cu(OH)2 
| O || C–OH | H–C–OH | OH–C–H | H–C–OH | H–C–OH | CH2–OH глюконовая кислота | + Cu2O↓ + 2H2O |
- окисление сильным окислителем:
| O || C–H | H–C–OH | OH–C–H | H–C–OH | H–C–OH | CH2–OH глюкоза | 
| O || C–H | H–C–OH | OH–C–H | H–C–OH | H–C–OH | C–OH || О глюкарова кислота | + Cu2O↓ + 2H2O |
3. брожение (ферментация):
- спиртовое:
C6H12O6  2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
- масялнокислое:
C6H12O6  CH3–CH2–CH2–C–OH + 2H2↑ + 2CO2↑
CH3–CH2–CH2–C–OH + 2H2↑ + 2CO2↑
||
O
- молочнокислое:
C6H12O6  2CH3–CH–CООH
2CH3–CH–CООH
|
OН
- лимоннокислое:
COOH
|
C6H12O6 + 3[O]  2H2O–HOOC–CH2–C–CH2–COOH
2H2O–HOOC–CH2–C–CH2–COOH
|
OН
лимонная кислота
Среди пентоз наиболее известны D-рибоза и ее производное 2-дезокси-D-рибоза, у которой нет гидроксильной группы при втором углеродном атоме. Эти моносахариды входят в состав рибо- и дезоксирибонуклеиновых кислот (РНК и ДНК) в фуранозной форме.
| | | |
Химические свойства обусловлены наличием:
1. карбонильной группы в открытых формах моносахаридов;
2. спиртовых гидроксильных групп как в открытых, так и в циклических формах моносахаридов;
3. полуацетальной гидроксильной группы в циклических формах моносахаридов.
Биологически важной альдогексозой является D-галактоза (ОН у четвертого атома С).
| | Н–C=О | H–C–OH | OH–C–H | ОH–C–H | H–C–OH | CH2–OH | |
Важнейшей кетогексозой является D-фруктоза. Для циклических форм фруктозы характерны фуранозная структура, которая образуется при взаимодействии кетонной группы со спиртовой при пятом углеродном атоме.
| | ← | | → | |
Сахароза.
| | |
Крахмал.
| | → | |
Амилоза – имеет α-конфигурацию, в результате чего полисахаридная цепь приобретает в пространстве строение, напоминающее спираль.
Амилопектин – имеет разветвленное строение; в основной цепи остатки D-глюкопиранозы связаны α-1-4 связью, а в местах ветвления α-1-6 связью; сходное строение с амилопектином имеет животный полисахарид гликоген.
Целлюлоза – самый распросраненный не только полисахарид, но и органическое вещество на земле (хлопок, лен – 100%, древесина – 50%).
Остатки D-глюкопиранозы связаны между собой β-1-4-гликозидной связью.
| | → | |
Дисахариды.
Строение:
1. молекулы могут содержать два остатка одного моносахарида или два остатка разных моносахаридов;
2. связи, образующиеся между остатками моносахаридов могут быть двух типов:
а) связь, образована полуацетальными гидроксилами обоих молекул – сахароза:
| | 
| |
б) связь, за счет полуацетального и спиртового –ОН – мальтоза и лактоза:
| | 
| |
Химические свойства:
I. Дисахариды, имеющие полуацетальный гидрокисл (мальтоза, лактоза) – сохраняют свойства альдегидов – «серебряное зеркало», с Cu(OH)2 при toC. Это восстанавливающие дисахариды. Есть невосстанавливающие – сахароза.
II. Как многоатомные спирты – образуют простые и сложные эфиры, дают качественные реакции многоатомных спиртов:
| | |
III. Гидролиз:
C12H22O11 + H2O 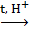 C6H12O6 + C6H12O6
C6H12O6 + C6H12O6
глюкоза фруктоза
Полисахариды.
Полисахариды – высокомолекулярные несахароподобные углеводы, содержащие от 10 до сотен тысяч остатков моносахаридов (обычно гексоз), связанных гликозидными связями.
Крахмал – из большого числа остатков α-глюкозы. Состоит из двух фракций: амилозы и амилопектина.
Амилоза – длинные неразветвленные цепи из остатков α-глюкозы (α-1,4-гликозидная связь), от 60 до 500 000 – относительная молекулярная масса. Закручены в спираль.
Амилопектин – молекулы сильно разветвлены. В основном α-1,4-гликозидная связь, но в точках разветвления есть α-1,6-гликозидные связи. Относительная молекулярная масса от 100 000 до 1 млн., но компактны.
Химические свойства:
1. Гидролиз:
(C6H10O5)n  (C6H10O5)x
(C6H10O5)x  C12H22O11
C12H22O11  n(C6H12O6)
n(C6H12O6)
декстрин мальтоза глюкоза
2. Качественная реакция на крахмал:
(C6H10O5)n + I2 → комплексное соединение сине-фиолетового цвета, при нагревании исчезает, при охлаждении восстанавливается
3. Реакции многоатомных спиртов – образование сложных и простых эфиров:
Целлюлоза – из остатков β-глюкозы – β-1,4-гликозид
| | → | |
Химические свойства:
1. Гидролиз:
(C6H10O5)n  у(C6H10O5)x
у(C6H10O5)x  n/2(C12H22O11)
n/2(C12H22O11)  n(C6H12O6)
n(C6H12O6)
целлобиоза β-глюкоза
2. Образование сложных эфиров:
а) HONO2 тринитроцеллюлоза:
ОН O–NO2
C6H7O2–OH + 3nHONO2  C6H7O2–O–NO2 + 3nH2O
C6H7O2–O–NO2 + 3nH2O
OH O–NO2
б) CH3C=O триацетат целлюлозы:
|
OH
| | 
| |
3. Горение:
(C6H10O5)n + 6nO2 → 6nCO2 + 5nH2O
4. Термическое разложение без доступа воздуха:
(C6H10O5)n  древесный уголь + H2O + летучее органическое вещество
древесный уголь + H2O + летучее органическое вещество
ФМ
Практическое занятие №7.
|
Просмотров 1918 |
|
|
