
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Аминокислоты – соединения, содержащие в своем составе амино- и карбоксильную группу
|
|
Значение аминокислот невозможно переоценить. В результате многолетних исследований было установлено, что белки – растительного, животного и микробного происхождения – построены из одних и тех же α-аминокислот, и только из α-аминокислот. Впечатляющее многообразие белков (а известны многие тысячи) объясняется с одной стороны варьированием количества α-аминокислот, с другой – взаимным расположением аминокислот.
Аминокислоты – одни из самых главных веществ живой природы. В настоящее время известно около 150 природных аминокислот, но только немногим более 20 из них являются важнейшими, так как из них построены главные «молекулы жизни» – белки.
Классификация, номенклатура, изомерия.
Аминокислоты – это производные УВ, содержащие аминогруппы (–NH2) и карбоксильные группы:
Общая формула (NH2)m R(COOH)n, где m и n чаще всего равны 1 или 2. Аминокислоты – соединения со смешанными функциями.
1. По числу функциональных групп:
| – моноаминомонокарбоновые кислоты | R–NH2 | COOH m=1, n=1 |
| – диаминомонокарбоновые кислоты | NH2 | R–NH2 | COOH m=2, n=1 |
| – моноаминодикарбоновые кислоты | NH2 | R–COOH | COOH m=1, n=2 |
2. По положению аминогруппы:
| – α-аминокислоты, например: | γ β α CH3–CH2–CH–C=O | | NH2 OH |
| – β-аминокислоты, например: | γ β α CH3–CH2–CH–C=O | | NH2 OH |
| – γ-аминокислоты, например: | γ β α CH3–CH2–CH–C=O | | NH2 OH |
Остатки около 20 α-аминокилот входят в состав белков.
3. По строению УВ радикала аминокислоты делят на:
| – алифатическая, например: | CH3–CH2–CH–C=O | | NH2 OH |
| – ароматические, например: | |
Для аминокислот используют:
- трививальные названия;
- рациональные названия – производят от названий соответствующей карбоновой кислоты, обозначая аминогруппу префиксом амино-, а карбоксильную группу как старшую – суффиксом –овая кислота.
Изомерия аминокислот обусловлена взаимным расположением аминогруппы и карбоксильной группы в открытой углеродной цепи или цикле. Алифатические аминокислоты подразделяются на α-, β-, γ-аминокислоты и т.д.
| β α CH3–CH–СООН | NH2 | 2-аминопропионовая кислота (α-аланин) |
| β α CH2–CH2–СООН | NH2 | 3-аминопропионовая кислота (β-аланин) |
| γ β α CH2–CH2–CH2–СООН | NH2 | 4-аминобутановая кислота (γ-аминомасляная кислота) |
Ароматические аминокислоты существуют в виде орто-, мета- и пара-изомеров.
| | | |
| о-аминобензойная кислота | m-аминобензойная кислота | n-аминобензойная кислота |
Способы получения.
Исходными соединениями для получения аминокислот служат карбоновые кислоты, в молекулы которых вводится аминогруппа:
а) из галогенозамещенных кислот – галоген замещается на аминогруппу (по механизму нуклеофильного замещения):
CH3–CH–COOH + 2NH3 → CH3–CH–COOH + NH4Br
| |
Br NH2
2-бромпропановая кислота 2-аминопропановая кислота
б) из альдегидов:
CH3–C=O  CH3–CH–C≡N
CH3–CH–C≡N  CH3–CH–C=O
CH3–CH–C=O
| | | |
H NH2 NH2 OH
ацетальдегид 2-аминопропанонитрил 2-аминопропанования кислота
Эти оба метода используют в основном для получения α-аминокилот.
в) гидролиз белков – получают смесь α-аминокислот, из которой с помощью специальных методов выделяют отдельные чистые аминокислоты;
г) из непредельных кислот – при взаимодействии α, β-ненасыщенны кислот с аммиаком образуются β-аминокислоты:
CH2=CH–COOH  H2N–CH2–CH–COOH
H2N–CH2–CH–COOH
|
H
акриловая кислота β-аланин
Химические свойства.
| H2N | –R– | COOH |
↓ ↓
основные свойства кислотные свойства
(свойства аминов) (свойства карбоновых кислот)
амфотерные свойства
I. Взаимодействие с основаниями и кислотами:
а) как кислота (за счет карбоксильной группы):
CH2–C=O + NaOH → CH2–C=O + H2O
| | | |
NH2 OH NH2 O–Na
глицин
б) как основание (за счет аминогруппы):
CH2–C=Oδ+ + Hδ-–Cl → CH2–C=O + Cl-
| | | |
NH2 OH NH2 O–Na
глицин
II. Образование внутренних солей (внутримолекулярное взаимодействие):
а) моноаминомонокарбоновые кислоты (нейтральные кислоты):
R–COOH ↔ R–COO- + H+ ↔ R–COO-
| | |
NH2 NH2 NH3+
pH = 7 внутренняя соль (биполярный ион)
б) в зависимости от расположения функциональных групп в молекуле реакция может протекать межмолекулярно или внутримолекулярно:
- α-аминокислоты превращаются при нагревании в дикетопиперазины – устойчивые шестичленные циклы:
| | 
| |
| α-аланин | 2,5-диметил-3,6-дикетопиперазин |
- β-аминокислоты при нагревании легко отщепляют аммиак, образуя α,β-непредельные кислоты:
β α
CH2–CH–COOH 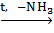 CH2=CH–COOH
CH2=CH–COOH
| |
NH2 H
β-аланин акриловая кислота
- γ-аминокислоты при нагревании могут принимать клешневидную конформацию; за счет сближения карбоксильной и аминогруппы протекает внутримолекулярная реакция с образованием лактамов:
| | 
| |
| γ-бутиролактам |
III. Взаимодействие аминокислот друг с другом – образование пептидов:
У дипептидов имеют свободные группы – амино- и карбоксильная, поэтому они могут взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид и далее тетрапептид и т.д.
Связь –С–N– называют пептидной (амидной).
|| |
O H
Некоторые аминокислоты нормального строения применяются для получения синтетических полипептидов (полиамидных волокон). Например, при поликонденсации ε-аминокапроновой кислоты получают полимер – капрон.
O O O O H O H O
|| || || || | || | ||
NH–(CH2)5–C + NH–(CH2)5–C + NH–(CH2)5–C …→ nH2O + NH–(CH2)5–C–N–(CH2)5–C–N–(CH2)5–C–
| | | | | |
H OH H OH H OH
Вопросы для контроля:
1. Какие вещества называются аминокислотами?
2. Как можно классифицировать аминокислоты?
3. Какие вам известны способы получения аминокислот?
4. В каких реакциях проявляются амфотерные свойства аминокислот? Приведите примеры.
5. Как будут действовать на индикаторы (лакмус, метиловый оранжевый) растворы:
- аланина: CH3–CH–C=O (α-аминопропионовая кислота)
| |
NH2 OH
- лизина:CH2–(CH2)3–CH–C=O (α,ε-диаминокапроновая кислота)
| | |
NH2 NH2 OH
- аспаргановая:O=C–CH2–CH–C=O (аминобутандионовая кислота)
| | |
OH NH2 OH
6. Что такое пептидная (амидная) связь?
Вопросы и задачи для самостоятельной работы:
1. Напишите уравнения реакций взаимодействия аланина:
а) с гидроксидом натрия;
б) с гидроксидом аммония;
в) с хлорводородной кислотой.
2. Назовите следующие дипептиды:
а) H2N–CH–CO–NH–CH–COOH
| |
CH3 CH3
б) H2N–CH–CO–NH–CH2–COOH
|
CH3
в)
3. Напишите структурные формулы и назовите дипептиды, которые могут быть получены из следующих аминокислот:
а) глицина и фенилаланина;
б) аланина и валина;
в) аланина и аланина.
4. Сколько литров 10% раствора NaOH (ρ = 1,1 г/мл) потребуется для нейтрализации аминоуксусной кислоты, полученной из карбида кальция массой 320 г?
5. Каким изменениям подвергаются при нагревании 2-амино-, 3-амино- и 4-аминобутановая кислоты? Подтвердите записями уравнений реакций.
Приложение 1.
|
Просмотров 2673 |
|
|
