
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Глава 1. СТРОЕНИЕ И СВОЙСТВА АМИНОКИСЛОТ
|
|
Давыдов В.В.
Д13 Основы общей биохимии: Учеб. пособие/ В. В. Давыдов, Н. Ф. Клещев. – Харьков: НТУ “ХПИ”, 2006. – 380 с. – На рус. яз.
ISBN
Учебное пособие содержит материалы по основным вопросам биологической химии в соответствии с программой обучения студентов по специальности “Промышленная биотехнология”.
Предназначено для студентов-биотехнологов.
Ил. 157. Табл. 4. Библиогр.: 16 назв.
ББК 28.072
ISBN © В.В. Давыдов,
|
Предисловие
Специфика биотехнологических процессов предъявляет особые требования к подготовке инженеров-биотехнологов. Большое место в ней занимает биологическая химия. Глубокое понимание биохимических процессов обеспечивает не только глубокое понимание сути биотехнологичес-их процессов, но и возможность творческого отношения специалиста к их оптимизации и модернизации.
В предлагаемом учебном пособии излагаются современные основы общей биохимии в объеме, соответствующем подготовке студентов по специальности “Промышленная биотехнология”. Пособие состоит из двух разделов. В первом из них излагаются современные представления о химичес-ких компонентах живых существ, а во втором – об обмене веществ. При рассмотрении обменных процессов основное внимание уделяется общим путям метаболизма, который сходно протекает в организмах, находящихся на разных ступенях эволюционного развития.
Авторы выражают глубокую благодарность В. В. Давыдову (младшему) за изготовление иллюстраций и Н. Д. Захаровой за помощь при подготовке учебного пособия к печати.
Вступление
Процессы жизнедеятельности обеспечиваются на химическом или точнее, молекулярном уровне. В этой связи познание тайн жизни, процессов ее зарождения, индивидуального развития и старения, а также использование живых организмов в биотехнологических процессах для решения конкретных производственных проблем, стало возможным, благодаря достижениям современной биохимии. Именно с развитием этой науки связаны революционные достижения последних лет в молекулярной биологии, медицине и биотехнологии.
В последние десятилетия происходит особенно бурное развитие биохимии. В мире выпускаются сотни научных биохимических журналов и издается огромное количество монографий по разным разделам биохимии. По данным литературы, период полуобновления знаний по этой науке сос-тавляет около пяти лет. Причиной этого является широкое внедрение в практическую биохимию тонких физико-химических методов исследований, позволяющих проводить фракционирование структурных компонентов сложных биологических систем, определять динамические изменения в структуре макромолекул и проводить мониторинг химических процессов непосредственно в живых организмах.
Биохимия – наука, которая изучает химический состав живых организмов, а также особенности строения их компонентов, их функции и химические превращения. Объектом биохимии являются организмы, стоящие на разных ступенях эволюционного развития. В зависимости от объекта выделяется несколько разделов биохимии: биохимия микроорганизмов, биохимия растений, биохимия животных и человека. Зародившись еще в IX веке, эта наука оказалась столь эффективной и плодотворной, что создала основу для всей современной биологии и предопределила формирование таких новых ее направлений, как молекулярная биология, молекулярная генетика, биотехнология и др.
Хотя биотехнология и интегрировала в себе такие научные направления, как генетика, микробиология и молекулярная биология, основу всех биологических технологий составляет именно биохимия. Это определяется тем, что инструментом биотехнологии являются ферменты, а действующими элементами – отдельные молекулы: нуклеиновые кислоты, белки, липиды, углеводы и др. В этой связи фундаментальное значение в подготовке специалистов-биотехнологов приобретает изучение основ биохимии.
В предлагаемом пособии излагаются основные положения биохимии, представляющие интерес для студентов биотехнологических специальностей.
РАЗДЕЛ I. ХИМИЧЕСКИЕ КОМПОНЕНТЫ
ЖИВЫХ ОРГАНИЗМОВ
Глава 1. СТРОЕНИЕ И СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты представляют собой аминопроизводные карбоновых кислот. В природе встречается больше 300 их представителей, 20 из которых являются обязательным структурным компонентом белков. Они определяются как стандартные аминокислоты. Строение 19 стандартных аминокислот соответствует следующей общей формуле:

где R – аминокислотный радикал.
Структура лишь одной аминокислоты – пролина – не соответствует общей формуле, приведенной в табл. 1. Это связано с тем, что пролин, собственно, и не является аминокислотой. Он представляет собой иминокислоту.
Таблица 1 – Строение стандартных аминокислот
| № п/п | Название | Структура |
| Аланин | 
|
Продолжение таблицы 1
| Лейцин | 
| |
| Пролин | 
| |
| Триптофан | 
| |
| Глицин | 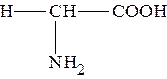
| |
| Треонин | 
| |
| Тирозин | 
| |
| Глутамин | 
| |
| Глутаминовая кислота | 
| |
| Аргинин | 
| |
| Валин | 
|
Продолжение таблицы 1
| Изолейцин | 
| |
| Фенилаланин | 
| |
| Метионин | 
| |
| Серин | 
| |
| Цистеин | 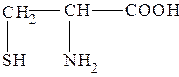
| |
| Аспарагин | 
| |
| Аспарагиновая кислота | 
| |
| Лизин | 
| |
| Гистидин | 
|
Как видно из представленной таблицы, стандартные аминокислоты, за исключением пролина, являются α-аминокислотами, т.е. аминогруппа в качестве заместителя располагается у α-углеродного атома согласно выше приведенной формуле.
В настоящее время существует множество классификаций стандартных аминокислот. Особое значение из них имеет классификация, предложенная А. Ленинджером. В ее основу положены различия в полярности радикала аминокислот (рис. 1).
. 
Рисунок 1 – Классификация стандартных аминокислот
Стандартные аминокислоты входят в состав полипептидных цепей белков в виде L-стереоизомеров. Из курса органической химии известно, что в состав органических молекул могут входить асимметрические (хиральные) углеродные атомы. Асимметрический углеродный атом представляет собой атом углерода, связанный с четырьмя различными заместителями (обозначен – С*).

Принимая во внимание особенности строения стандартных аминокислот, можно предположить, что все они, за исключением глицина, у которого α-углеродный атом связан с двумя атомами водорода, будут содержать, как минимум, один асимметрический углеродный атом.
Молекулы, содержащие асимметрический углеродный атом, представлены стереоизомерами двух рядов – L и D. Принадлежность к соответствующему стереохимическому ряду определяется путем сравнения структуры молекулы с эталонным соединением. В качестве эталонного соединения используют глицериновый альдегид. Как и все соединения, содержащие асимметрический углеродный атом, глицериновый альдегид представлен L- и D-стереоизомерами:


L-Глицериновый альдегид D-Глицериновый альдегид
Принадлежность аминокислоты к соответствующему стереохимичес-кому ряду определяют по месту положения ее α-аминогруппы относительно углеводородного скелета. Если она располагается с той же стороны, что и гидроксильная группа у хирального углеродного атома глицеринового альдегида, то аминокислота относится к тому же стереохимическому:


L-Аланин D-Аланин
Молекулы стереоизомеров D- и L-ряда являются зеркальным отражением друг друга. Они обладают одинаковыми химическими свойствами. Однако их физические свойства существенно различаются. Так, стереоизомеры разных рядов обладают разной способностью вращать плоскость поляризованного луча света. В зависимости от направления вращения луча они подразделяются на вправо- и влевовращающие. Растворы стереоизомеров D- и L-ряда вращают плоскость поляризованного луча света на разный угол.
Стереоизомеры способны превращаться друг в друга. Этот процесс получил название рацемизация. Процесс рацемизации можно представить в виде следующего уравнения:
 |
L-Аланин D-Аланин
В состав полипептидных цепей белков входят стереоизомеры только
L-ряда. Вместе с тем в природе встречаются и D-стереоизомеры аминокислот. Они входят в состав оболочек микробных клеток (D-фенилаланин), некоторых антибиотиков (грамицидин-S) и др.
Помимо стандартных аминокислот, в состав белков могут входить и нестандартные аминокислоты. К ним относятся производные стандартных аминокислот – оксипролин (производное пролина), оксилизин (производное лизина), десмозин (производное фенилаланина), тиронин (производное тирозина) и др.


Оксилизин Оксипролин
Все эти аминокислоты входят в состав только определенных белков. Так, оксипролин и оксилизин являются структурными компонентами белка коллаген, десмозин – белка эластин, тиронин – белка тиреоглобулин.
Некоторые аминокислоты могут вообще не входить в состав белков, хотя в значительных количествах содержатся в живых организмах. К ним относятся: цитруллин, орнитин, диоксифенилаланин (ДОФА), гомоцистеин и др.


Орнитин Диоксифенилаланин (ДОФА)
Особое место среди нестандартных аминокислот, которые не входят в состав белков, имеют β- и γ-аминокислоты.


β-Аланин γ-Аминомасляная кислота (ГАМК)
В состав аминокислот входят функциональные группы, которые в полярных растворителях (воде) могут подвергаться диссоциации:

В этой связи в водных растворах молекулы аминокислот могут приобретать заряд. В зависимости от условий, которые определяют состояние ионизации функциональных групп, молекула аминокислоты может находиться в трех состояниях:

Центральное место при этом занимает состояние, в котором первичная карбоксильная и α-аминогруппы ионизированы. В этом состоянии молекула не несет суммарного электрического заряда и представляет собой биполярный ион (цвиттерион), в котором электрические заряды скомпенсированы. В форме цвиттериона молекула аминокислоты существует только при определенном значении рН, которое называется изоэлектрической точкой. Каждая аминокислота имеет характерную для нее величину изоэлектрической точки, которая определяется структурой аминокислотного радикала.
При значении рН, отличающемся от изоэлектрической точки, молекула аминокислоты приобретает заряд:

Как видно, при рН меньше изоэлектрической точки аминокислота приобретает положительный заряд, при величине больше изоэлектрической точки – отрицательный заряд. При этом величина электрического заряда тем больше, чем больше величина рН отличается от изоэлектрической точки.
Свойство аминокислот находиться в водных растворах в виде ионов используется для разделения их смесей при анализе аминокислотного состава биологических объектов. Для этой цели могут быть использованы следующие методы:
· ионообменная хроматография;
· электрофорез.
Эти методы находят широкое применение для аналитических целей в биохимии.
|
Просмотров 5551 |
|
|
