
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Общие принципы строения нуклеиновых кислот
|
|
Важнейшим компонентом живых организмов, обитающих на нашей планете, являются нуклеиновые кислоты. Подобно белкам они выступают в качестве обязательного компонента животных и растительных клеток, микроорганизмов и даже существ, стоящих на грани живого – вирусов и фагов.
Нуклеиновые кислоты представляют собой высокомолекулярные полимерные органические соединения, мономером которых являются мононуклеотиды. Такм образом нуклеиновые кислоты по химической природе представляют собой полинуклеотиды.
Нуклеиновые кислоты подразделяются на две основные группы:
1) дезоксирибонуклеиновые кислоты (ДНК);
2) рибонуклеиновые кислоты (РНК).
Обе группы нуклеиновых кислот существенно различаются по локализации в клетках, функции и строению. Так, ДНК содержится в ядре клетки и митохондриях, а РНК – в ядрышке, цитоплазме и рибосомах. Подобная внутриклеточная локализация ДНК и РНК определяется характером выполняемой ими функций.
Основной функцией ДНК является хранение генетической информации. В структуре ДНК заложена информация о составе белков, характерных для данного организма. РНК принимает участие в передаче генетической информации. Кроме того, этот вид нуклеиновых кислот принимает участие в активации и транспорте аминокислот в процессе белкового синтеза, а также выполняет структурную роль, принимая участие в образовании рибосом.
Структурным компонентом нуклеиновых кислот являются мононуклеотиды. Последние представляют собой низкомолекулярные органические соединения, в состав которых входят:
· азотистое основание;
· углеводный компонент (пентоза);
· остаток орто-фосфорной кислоты.
Азотистые основания, входящие в состав природных мононуклеотидов, являются производными пурина (аденин и гуанин) или пиримидина (урацил, тимин и цитозин):



Пурин Аденин (А) Гуанин (Г)


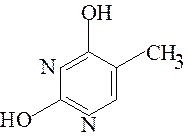

Пиримидин Урацил (У); Тимин (Т) Цитозин (Ц)
Углеводный компонент нуклеиновых кислот может быть представлен рибозой или 2'-дезоксирибозой:


Рибоза 2'-Дезоксирибоза
Углеводный компонент и азотистое основание соединяется друг с другом при помощи N-гликозидной связи. Соединения, образованные азотистым основанием и пентозой, связанные гликозидной связью, называются нуклеозидами. Ниже приведена структура двух различных нуклеозидов – аденозина и 2'-дезокситимидина:


Аденозин 2'-Дезокситимидин
Нуклеозиды, помимо того что входят в структуру мононуклеотидов, встречаются в клетках в свободном состоянии. При этом они проявляют определенную биологическую активность. Так, широко распространенный в животных организмах нуклеозид аденозин играет важную регуляторную роль. На клетках тканей внутренних органов животных к нему существуют специфические рецепторы. Под контролем этого нуклеозида находится тонус гладкомышечных клеток. Помимо этого, аденозин участвует в приспособлении животных клеток к существованию в условиях недостатка кислорода.
Мононуклеотиды представляют собой фосфорнокислые производные нуклеозидов. Фосфорилирование нуклеозидов происходит по пятому углеродному атому пентозы. По этой причине названия мононуклеотидов образуются путем прибавления к названию нуклеозида окончания – 5'-мо-нофосфат (так называемом аденозин-5'-монофосфат, гуанозин-5'-мо-нофосфат, уридин-5'-монофосфат и т.д.). Ниже представлена структура аденозин-5'-монофосфата и 2'-дезокситимидин-5'-монофосфата.


Аденозин-5'-монофосфат (АМФ) 2'-Дезокситимидин-5'-монофосфат
(дТМФ)
В зависимости от структуры входящего в состав азотистого основания мононуклеотиды подразделяются на:
· пуриновые мононуклеотиды;
· пиримидиновые нуклеотиды.
В зависимости от структуры входящего в состав мононуклеотида углеводного компонента они подразделяются на:
· рибонуклеотиды;
· 2’-дезоксирибонуклеотиды.
В живых организмах мононуклеотиды встречаются не только в сос-таве нуклеиновых кислот. В клетках довольно широко присутствуют их свободные формы, а также различные производные. Широкое распространение среди них имеют нуклеозиддифосфаты и нуклеозидтрифосфаты, которые представляют собой соответственно дифосфорные и трифосфорные производные нуклеозидов. Особое значение из них приобретают нуклеозидтрифосфаты – АТФ (аденозинтрифосфорная кислота), ГТФ (гуанозинтрифосфорная кислота), ЦТФ(цитидинтрифосфорная кислота) и УТФ (уридинтрифосфат), которые представляют собой макроэргические соединения. Они играют важную роль в энергетическом обеспечении клетки и активации различных органических молекул в процессе их внутриклеточного превращения. АТФ выполняет роль универсального источника энергии. Ниже, представлена структура АТФ и продукта его гидролиза – АДФ.

АТФ

АДФ
В животных клетках встречаются циклические производные мононуклеотидов – циклический АМФ и циклический ГМФ. Они выполняют функцию вторичных посредников гормонов и различных других биологи-ческих веществ в клетке. Структура циклического АМФ (ц-АМФ):

В достаточно высоких концентрациях в клетках содержатся производные мононуклеотидов – динуклеотиды, которые входят в состав каталитических белков (ферментов). К ним относятся НАД (никотинамидадениндинуклеотид), НАДФ (никотинамидадениндинуклеотидфосфат), ФАД (флавинадениндинуклеотид) и др. Структура НАД включает остаток АМФ, который связан с помощью 5'5'-фосфодиэфирной связи с необычным мононуклеотидом НМФ (никотинамидмононуклеотид), в состав которого в качестве азотистого основания входит никотин амид:

Структура НАД
Однако большая часть мононуклеотидов в клетках находится в связанном состоянии в составе нуклеиновых кислот. В нуклеиновых кислотах они соединяются друг с другом при помощи 3'5'-фосфодиэфирной связи (рис. 17). При подобного рода соединении мононуклеотидов образуются полинуклеотидные цепи различной длины. Полинуклеотидная цепь имеет полярную структуру, в которой выделяются два противоположных конца – 3'-конец и 5'-конец. На 3'-конце находится свободная ОН-группа у третьего углеродного атома пентозы, а на 5'-конце – у пятого углеродного атома пентозы.
В природе встречаются нуклеиновые кислоты двух типов – ДНК и РНК которые существенно различаются по строению, функции и локализации в клетках. Особенности их внутриклеточной локализации и функции уже были описаны в начале главы. Структурные различия связаны со следующим:
· в качестве азотистых оснований в состав ДНК входит А, Г, Ц, Т, а в состав РНК – А, Г, Ц, У;
· в качестве углеводного компонента в состав ДНК входит 2'-дезок-сирибоза, а РНК – рибоза;
· молекула ДНК состоит из двух полинуклеотидных цепей, а РНК – одной.


Рисунок 17 – Строение фрагмента молекулы ДНК
(обозначен свободный 3'-конец молекулы)
Строение ДНК
Молекула ДНК имеет сложную структуру, которая характеризуется тремя уровнями организации.
Первичная структура ДНКпредставлена полинуклеотидными цепями, которые образованы мононуклеотидными остатками, соединенными в единую полинуклеотидную цепь. В состав молекулы ДНК в зависимости от вида организма могут входить до нескольких миллионов нуклеотидов. Молекула ДНК кодирует структуру белков (их аминокислотный состав), которые входят в состав клетки и организма в целом. В основе кодирования (генетического кода) лежит триплет (три последовательно стоящие в полинуклеотидной цепи) мононуклеотидов. В настоящее время имеются четкие представления о том, какой триплет нуклеотидов кодирует структуру какой аминокислоты (табл. 1). Фрагмент ДНК, кодирующий структуру одного белка, называется геном.
Таблица 1 – Генетический код (примеры отдельных триплетов нуклеотидов, кодирующих структуру аминокислот в полипептидных цепях белков)
| УУУ | УЦУ | УАУ | УГУ | ЦУУ |
| Фенила-ланин | Серин | Тирозин | Цистеин | Лейцин |
| ЦЦУ | ЦАУ | ЦГУ | АУУ | АЦУ |
| Пролин | Гистидин | Аргинин | Изолейцин | Треонин |
Важную роль в расшифровке первичной структуры ДНК сыграло открытие, сделанное в середине прошлого столетия Эрвином Чаргаффом и его коллегами из Колумбийского университета. Им было доказано, что между различными азотистыми основаниями, включенными в структуру ДНК, существуют определенные количественные взаимоотношения. Э. Чаргафф сформулировал следующие правила.
1. ДНК из различных клеток многоклеточного организма имеют одинаковый нуклеотидный состав.
2. В процессе жизни не происходит изменения нуклеотидного сос-тава ДНК.
3. Нуклеотидный состав ДНК у организмов разных видов различается.
4. В ДНК содержание А = Т, а Г = Ц. При этом общее содержание пуриновых оснований равно сумме пиримидиновых (А + Г = Т + С).
Проведенные в 50-х годах прошлого века исследования Джеймса Уотсона и Френсиса Крика позволили установить причину обнаруженных Э. Чаргаффом правил. С помощью метода рентгеноструктурного анализа было показано, что молекула ДНК состоит из двух полинуклеотидных цепей, имеющих структуру двойной закрученной вправо спирали. Полный оборот спирали составляет 10 нуклеотидных пар. Обе полинуклеотидные цепи различаются по последовательности включенных в состав мононуклеотидов азотистых оснований и их составу (рис. 18). Однако они являются комплементарными друг другу и антипараллельными (имеют противоположное направление в пространстве).

Рисунок 18 – Антипараллельная и комплементарная структура
полинуклеотидных цепей ДНК
Цепи определенным образом ориентированы. Составляющие их остов остатки связанных друг с другом остатков фосфорной кислоты и рибозы располагаются снаружи и контактируют с окружающей средой (рис. 19). Остатки азотистых оснований уложены стопкой внутри двойной спирали и расположены перпендикулярно цепи. При этом основания одной цепи взаимодействуют с находящимися в этой же плоскости комплементарными основаниями другой цепи.

Рисунок 19 – Строение молекулы ДНК (В.П.Комов и В.Н.Шведова, 2004)
Комплементарные взаимодействия возникают за счет водородных связей между соответствующими по пространственной структуре азотис-тыми основаниями (рис. 20). Комплементарными являются остатки А и Т, Г и Ц (т.е. пары, “пуриновое – пиримидиновое основание”). Между аденином и тимином возникают три водородные связи, а между цитозином и гуанином – две. Многочисленные водородные связи между комплементарными азотистыми основаниями прочно удерживают полинуклеотидные цепи в единой молекуле.

Рисунок 20 – Комплементарные взаимодействия между азотистыми
основаниями мононуклеотидов (Дэвидсон Дж., 1976)
Объединение двух полинуклеотидных цепей в единую молекулу и образует вторичную структуру ДНК. Расплетение двухцепочной молекулы представляет собой процесс ее денатурации. Денатурация может возникать при нагревании растворов ДНК (рис. 21). Под влиянием высокой температуры происходит разрыв водородных связей между комплементарными азотистыми основаниями, что приводит к расплетению цепей ДНК. Температура денатурации (плавления) ДНК определяется нуклеотидным составом. Чем больше в молекуле пар Г-Ц, тем эта температура выше. Освобождающиеся при денатурации полинуклеотидные цепи принимают структуру хаотического клубка.

Рисунок 21 – Механизм термоденатурации (плавления) ДНК
Подобно белкам, денатурированные нуклеиновые кислоты способны к ренатурации. Этот процесс возникает при постепенном понижении температуры раствора и восстановлении его рН.
Молекула ДНК имеет большую длину. Так, длина кольцевой ДНК из E.сoli составляет около 1,4 мм, а общая длина всех молекул ДНК соматичес-кой клетки человека достигает 2 м. Нетрудно себе представить, что длина молекулы ДНК просто несоизмерима с размерами клетки. Поэтому для ее укладки внутри клеточного ядра требуется специальная упаковка.
Пространственная упаковка двуспиральной молекулы ДНК представляет собой ее третичную структуру. В клетках прокариот ДНК подвергается циклизации с образованием кольцевой структуры. Эта кольцевая молекула подвергается суперспирализации, после чего прикрепляется к особым участкам клеточной мембраны (рис. 22). Процесс суперспирализации обеспечивается определенными белками, включенными в состав хроматина.

Рисунок 22 – Суперспирализация кольцевой бактериальной ДНК
(А. Ленинджер, 1985)
В клетках эукариот ДНК не образует кольцевых структур. В делящихся клетках они включены в состав хромосом. В соматических клетках человека содержится 46 хромосом. В состав каждой из них входит одна двухцепочная молекула ДНК. ДНК разных хромосом различна по длине и несет свой уникальный набор генов. В ядре каждой соматической клетки содержится ДНК, характерная для данного организма, формирующая геном клетки.
В неделящихся клетках эукариот ДНК входит в состав особой ядерной субстанции – хроматина. Хроматин состоит на 60 % из белка, 35 % – ДНК и 5 % – РНК. Он представлен хроматиновыми волокнами, которые формируют особые структуры – нуклеосомы (рис. 23).
Нуклеосомы имеют форму бус – нуклеиновая кислота особым образом обматывает комплексы из 8 белков – гистонов. В состав этих белков входит большое количество основных аминокислот (аргинина и лизина), которые при физиологических значениях рН несут положительный заряд. В этих же условиях остатки фосфорной кислоты, включенные в остов молекулы ДНК, несут отрицательный заряд, за счет которых и вся молекула ДНК приобретает выраженный отрицательный заряд. В результате наличия противоположных зарядов на ДНК и гистонах между ними возникают электростатичес-кие взаимодействия, которые стабилизируют нуклеопротеидные комплексы нуклеосом.

Рисунок 23 – Строение нуклеосомы (А. Ленинджер, 1985)
Строение РНК
Молекулы РНК представлены в различных внутриклеточных отсеках, более широко чем ДНК. Они имеют значительно меньшую молекулярную массу и представлены единственной полинуклеотидной цепью. Однако в процессе формирования вторичной структуры возможно появление двухцепочных участков, которые возникают в результате образования водородных связей между комплементарными азотистыми основаниями внутри полинуклеотидной цепи за счет ее специфической укладки в пространстве.
Существуют три основные разновидности РНК: транспортная
(т-РНК), рибосомальная (р-РНК) и матричная (м-РНК). Все эти разновидности РНК имеют свои характерные структурные особенности. Они различаются по функции и локализации в клетке:
1. м-РНК. Является продуктом транскрипции ДНК, несет в себе информацию о структуре белков. Локализуется в ядре и цитоплазме клетки. Участвует в переносе генетической информации с ДНК на белок;
2. т-РНК. Принимает участие в активации и транспорте аминокислот в процессе биосинтеза белка. Находится в цитоплазме клетки. Имеет наименьшую молекулярную массу среди других видов РНК. В состав т-РНК в значительных количествах входят минорные мононуклеотиды, которые практически не встречаются в других видах РНК (содержащие в составе тимин, а также различные производные азотистых оснований);
3. р-РНК. Входит в состав рибосом, принимает участие в процессе трансляции.
Помимо этого в ядре клетки эукариот присутствует малая ядерная РНК (мя-РНК), которая принимает участие в подготовке м-РНК к процессу трансляции.
Особенности строения м-РНК
м-РНК представляют собой одноцепочные молекулы разной длины. Они могут содержать в себе информацию о структуре одного (моногенные) или большего числа генов (полигенные). Полигенные м-РНК обычно кодируют белки, которые принимают участие в одних и тех же обменных процессах. Масса молекулы м-РНК определяется количеством аминокислот в белке с учетом того, что одна аминокислота кодируется тремя нуклеотидными остатками.
Длина молекулы м-РНК больше длины соответствующего гена. Это связано с тем, что на 5'-конце ее полинуклеотидной цепи содержится особая структура – “лидер“, представляющая собой некодирующую последовательность, содержащую от 25 до 150 нуклеотидов. Помимо этого в сос-тав полигенных м-РНК входят межгенные области – спейсеры (рис. 24).

Рисунок 24 – Строение м-РНК
Особенности строения т-РНК
т-РНК представляют собой сравнительно небольшие молекулы, полинуклеотидная цепь которых включает несколько десятков (до сотни) мононуклеотидов. Существует большое количество т-РНК, однако все они имеют общие характерные черты строения (рис. 25).

Рисунок 25 – Строение т-РНК
На 5'-конце у них находится остаток гуанина (G), а на 3'-конце – последовательность нуклеотидов, представляющая соединение – С-А-А. В состав нуклеотидов т-РНК входит значительное количество минорных азотистых оснований, т.е. азотистых оснований, необычных для РНК (инозин, дигидроуридин, метилгуанозин, тимин). Их содержание в молекуле велико и может составлять до 10 % от общего количества.
В пространстве молекула т-РНК приобретает характерную в форме кленового листа укладку, которая стабилизируется многочисленными водородными связями, возникающими между сближенными в пространстве комплиментарными азотистыми основаниями нуклеотидов, находящихся внутри одной полинуклеотидной цепи.
В молекуле т-РНК формируется несколько функциональных структур, которые позволяют ей взаимодействовать с матричной РНК (антикодон) и связывать аминокислоту (акцепторная ветвь). Более детально особенности строения этих функциональных участков молекулы будут рассматриваться в процессе обсуждения вопросов, касающихся биосинтеза белка.
Контрольные вопросы
1. Дайте определение понятия “нуклеиновая кислота”.
2. Что такое нуклеозиды? Какую они выполняют биологическую роль?
3. Что вы можете сказать о биологической роли свободных нуклеотидов и их производных?
4. От чего зависит температура плавления ДНК?
5. Что такое хроматин? Каков его химический состав?
6. Что вы можете сказать об особенностях строения м-РНК человека?
7. Что такое минорные мононуклеотиды? В состав каких разновидностей РНК они входят в значительных количествах?
Глава 5. ФЕРМЕНТЫ
Ферменты представляют собой белки – катализаторы. Подобно небелковым катализаторам они ускоряют достижение состояния химического равновесия в реакциях. При этом в процессе реакции они не расходуются. Однако в отличие от небелковых катализаторов ферменты обладают:
· значительно более высокой каталитической мощностью;
· более высокой специфичностью действия;
· способностью проявлять эффект в мягких условиях (рН, близкая к нейтральной, температура в пределах 28–37 оС, нормальное давление).
Благодаря ферментам обеспечивается возможность последовательного и целенаправленного течения химических реакций в живых организмах и тем самым обеспечивается сама возможность существования живой материи. Это связано с тем, что помимо прочего, характерной чертой живой материи является именно обмен веществ. Подавляющее же большинство химических превращений в живых организмах (до 85–90 %) имеет каталитическую природу, т.е. обеспечивается присутствием ферментов.
Уже в 30-ые годы прошлого века были получены убедительные доказательства того, что ферменты представляют собой белки. Важным аргументом в пользу белковой природы ферментов послужило их свойство подвергаться денатурации. Причем, как это и следовало ожидать, денатурация ферментов сопровождается потерей их каталитических свойств.
Мир ферментов чрезвычайно разнообразен. Они сильно различаются по молекулярной массе, которая колеблется от 10 кДа до 1000 кДа. При этом они в большинстве своем значительно превышают молекулярную массу превращаемых ими веществ.
Среди ферментов существуют представители, которые являются простыми (химотрипсин, пепсин, рибонуклеаза и др.) или сложными (дегидрогеназы, трансферазы и многие др.) белками.
Ферменты, представляющие собой сложные белки, имеют определенные черты строения. Они состоят из:
1) термолабильной части, которая представляет собой белковый компонент и обозначается как апофермент;
2) термостабильной части, представляющей собой небелковый компонент молекулы –кофермент.
Наиболее просто устроенный кофермент, представленный атомом металла (например, цинком в РНК-полимеразе, молибденом в альдегидоксидазе и др.), обозначается как кофактор. Небелковый компонент может быть по-разному связан с апоферментом. В том случае, если соединение обеспечивается прочной ковалентной связью, кофермент обозначается как простетичес-кая группа фермента (гем в составе ферментов гемопротеидов – цитохромов, флавиновая группа в молекулах флавиновых дегидрогеназсукцинатдегидрогеназе и др.). Значительно коферменты представлены различными производными витаминов.
В целом молекула активного фермента – сложного белка обозначается термином холофермент:
Холофермент = Апофермент + Кофермент.
В процессе катализа принимает участие лишь небольшая часть молекулы фермента, которая получила особое название – “активный центр”. Активный центр представляет собой участок молекулы фермента, в котором происходит связывание и химическое превращение субстрата. Субс-тратами фермента являются молекулы, которые подвергаются превращению в процессе ферментативной реакции.
Как правило, активный центр фермента составляет лишь очень малую часть от общей поверхности молекулы фермента. Он локализуется на неровностях молекулы, в области углублений, расщелин и пр. По периферии активного центра фермента находится особая структура – гидрофобный карман. Он образуется за счет сближенных в пространстве радикалов неполярных аминокислот, которые формируют своеобразную гидрофобную область на молекуле. Наличие этой гидрофобной области вокруг активного центра способствует повышению эффективности взаимодействий субстрата с активным центром.
Активный центр фермента представляет собой трехмерную структуру, которая образована сближенными в пространстве аминокислотными радикалами, как правило, далеко отстоящими друг от друга в полипептидной цепи. Каждый из аминокислотных остатков активного центра выполняет в нем определенную функцию. В структуре активного центра выделяется два функционально неоднозначных участка – субстратный и каталитический.
В субстратном участке происходит связывание субстрата, а в каталитическом – его химическое превращение. Если в состав фермента входит кофермент, то, как правило, он входит в состав каталитического участка активного центра.
Ферменты обладают характерной локализацией в клетках эукариот. Одни из них более или менее гомогенно распределены во внутриклеточных компартментах, а другие локализуются только в определенных структурах клетки. Среди ферментов, имеющих специфическое распределение внутри клетки, особое значение имеют следующие:
· 5'-нуклеотидазаиNa+-K+-АТФаза – в наружной клеточной мембране;
· арилсульфатаза – в эндоплазматическом ретикулуме;
· сукцинатдегидрогеназа – во внутренней митохондриальной мембране;
· каталаза – в лизосомах;
· лактатдегидрогената и аминотрансферазы – в цитозоле.
Все эти ферменты являются своеобразными “маркерами” соответствующих внутриклеточных структур и используются для характеристики чистоты выделения различных субклеточных фракций.
Классификация ферментов
В основу существующей классификации положен тип реакции, катализируемой ферментом. По этому признаку все ферменты подразделяются на шесть основных классов:
1) оксидоредуктазы – катализируют окислительно-восстанови-тельные реакции;
2) трансферазы– катализируют реакции переноса функциональных групп между молекулами субстратов;
3) гидролазы – катализируют реакции гидролиза;
4) лиазы– катализируют реакции негидролитического распада молекул;
5) изомеразы – катализируют реакции внутри молекулярного переноса функциональных групп (изомеризации);
6) лигазы (синтетазы) – катализируют реакции присоединения путем образования новых связей ( С–С С–О С–N).
Номенклатура ферментов
Отдельные ферменты имеют тривиальные названия – трипсин, пепсин, цитохром с, и т.д. Эти названия сложились исторически и до сих пор широко используются.
Названия же большинства ферментов образуются путем прибавления суффикса ”аз” к названию субстрата, превращение которого катализируется ферментом. Например:
· амилаза,
· глюкозо-6-фосфатаза,
· аргиназа и др.
Наибольшее распространение получила международная номенклатура ферментов. Согласно ей названия ферментов складываются из названия субстратов и типа катализируемой реакции. Например, фермент глюкокиназа катализирует реакцию фосфорилирования глюкозы согласно следующего уравнения:

Систематическое название этого фермента – АТФ: D-глюкоза –
6-фосфотрансфераза.
|
Просмотров 2346 |
|
|
