
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Регуляция активности ферментов
|
|
Активность ферментов может изменяться под влиянием различных внешних факторов. Вещества, способные оказывать влияние на активность ферментов, обозначают как модуляторы ферментов. В свою очередь модуляторы подразделяют на две группы:
1. Активаторы. Под их влиянием происходит увеличение активности ферментов. В качестве активаторов могут выступать катионы металлов. Например, Na+ является активатором амилазы слюнных желез человека.
2. Ингибиторы. Вещества, под влиянием которых происходит уменьшение активности ферментов.
Ингибиторы представляют большую группу веществ, которые различаются по механизму ингибирующего действия.
По продолжительности ингибирующего эффекта ингибиторы подразделяются на:
· необратимые (которые при взаимодействии с ферментом навсегда лишают его ферментативной активности);
· обратимые (которые временно уменьшают активность фермента).
Механизм действия необратимых ингибиторов можно описать следующим уравнением:
In + E 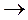 EIn,
EIn,
где EIn – комплекс фермента с ингибитором, в котором он не обладает каталитическими свойствами.
Как правило, необратимые ингибиторы взаимодействуют с функциональными группами активного центра фермента. Они ковалентно соединяются с ними и, таким образом, блокируют их. В результате этого фермент утрачивает способность взаимодействовать с субстратом.
Классическим примером необратимых ингибиторов являются фосфорорганические вещества. В течение многих лет в качестве такового в биохимических исследованиях используется диизопропилфторфосфат (ДФФ). Фосфорорганические соединения соединяются с остатком серина в активном центре фермента:
 |
К ферментам, которые содержат в активном центре серин, относятся холинэстераза, трипсин, эластаза и др.
В качестве других необратимых ингибиторов широкое применение находят алкилирующие агенты. Эти соединения взаимодействуют с SH-группами цистеина или имидазальными радикалами гистидина в активном центре. Механизм необратимого ингибирования ферментов иодацетамидом:

В качестве алкилирующих агентов как необратимых ингибиторов в биохимии находят применение иодацетамид, монойодацетат и др.
Явление необратимого ингибирования используется в народном хозяйстве и медицине. На нем основано применение инсектицитов (средств для борьбы с насекомыми), некоторых лекарственных препаратов (антихолинестеразные средства). На их основе созданы боевые отравляющие вещества нервно-паралитического действия из группы фосфорорганических соединений.
В отличие от ингибиторов необратимого действия обратимые ингибиторы лишь на определенный промежуток времени понижают активность ферментов. Механизм их ингибирующего эффекта можно представить в виде следующих уравнений реакций:
In + E  EIn
EIn
In + ES  ESIn
ESIn
Как следует из представленных уравнений реакций, обратимые ингибиторы обратимо присоединяются к ферменту или фермент-субс-тратному комплексу. При этом фермент утрачивает свои каталитические свойства.
Обратимые ингибиторы по механизму ингибирующего эффекта подразделяются на конкурентныеинеконкурентные,которые отличаются друг от друга по механизму ингибирующего действия на фермент.
В случае неконкурентного ингибирования ингибитор обратимо присоединяется к ферменту не в его активном центре. В этом случае меняется конформация активного центра, что приводит к обратимой инактивации энзима. Под влиянием конкурентного ингибитора не происходит изменения сродства фермента к его субстрату, т.е. не изменяется величина Км, но понижается максимальная скорость ферментативной реакции (Vmax). В качестве неконкурентных ингибиторов могут выступать промежуточные продукты обмена веществ.
Молекулы конкурентных ингибиторов имеют определенное сходство с истинным субстратом фермента. Классическим примером конкурентных ингибиторов является малоновая кислота, которая обратимо понижает активность фермента сукцинатдегидрогеназы.


Янтарная кислота Малоновая кислота
Из представленных формул видно, что малоновая кислота действительно сильно напоминает по строению янтарную. Структурное сходство позволяет малоновой кислоте связываться с активным центром фермента сукцинатдегидрогеназы. Однако это соединение не способно вступать в реакцию, катализируемую данным ферментом (реакцию дегидрирования). Поэтому ингибитор присоединяется к активному центру фермента, блокируя тем самым возможность его взаимодействия с истинным субстратом. Таким образом, под влиянием конкурентного ингибитора резко понижается срод-ство фермента к субстрату (возрастает величина Км), но не меняется величина Vmax. Явление конкурентного ингибирования может быть снято путем резкого повышения концентрации субстрата в реакционной смеси.
Таким образом, конкурентные ингибиторы в отличие от неконкурентных связываются с активным центром фермента, вследствие чего наступает резкое повышение величины Км к субстрату, что и лежит в основе обратимого понижения его активности.
В качестве физиологического конкурентного ингибитора сукцинатдегидрогеназы выступает щавелево-уксусная кислота. Как видно из представленного рисунка, этот промежуточный продукт обмена веществ также имеет определенное структурное сходство с янтарной кислотой. Конкурентное ингибирование сукцинатдегидрогеназы щавелево-уксусной кислотой играет важную роль в регуляции окислительно-восстановительных превращений в митохондриях:

Существует еще один вид регуляции активности ферментов – аллостерическая регуляция. Он характерен для особой группы энзимов – аллостерических ферментов. К аллостерическим ферментам относятся олигомерные белки, в структуре которых имеются регуляторные (аллостерические) центры.
В составе молекул аллостерических ферментов выделяются два типа субъединиц:
1) каталитические(С);
2) регуляторные (R).
Каталитические субъединицы представлены полипептидной цепью, на которой находится активный центр фермента. Регуляторные субъединицы содержат в своей структуре регуляторный (аллостерический) центр. Аллостерический центр представляет собой участок молекулы, способный специфически взаимодействовать с регулятором фермента. Соответственно регуляторы могут выступать в роли как активаторов, так и ингибиторов фермента.
Связывание аллостерического регулятора с регуляторным центром происходит за счет стерического соответствия его молекулы аллостеричес-кому центру. Ввиду геометрического сходства поверхности молекулы регулятора и трехмерной структуры аллостерического центра между ними происходит обратимое специфическое взаимодействие. Образуется комплекс, который стабилизируется силами слабых взаимодействий. Особое значение при этом приобретают Ван-дер-Ваальсовы силы. Помимо них, в стабилизации комплекса регулятора с аллостерическим центром участвуют водородные связи, а также гидрофобные и электростатические взаимодействия.
В результате взаимодействия фермента с аллостерическим ингибитором в молекуле белка возникают конформационные сдвиги в полипептидной цепи регуляторной субъединицы. Их возникновение сказывается на взаимодействии С- и R-субъединиц. В результате этого вторично изменяется конформация полипептидной цепи каталитической субъединицы. Подобная перестройка сопровождается возникновением сдвигов в структуре активного центра, следствием чего служит понижение сродства активного центра к субстрату (повышение величины Км), что и предопределяет ингибирование фермента (рис. 33).
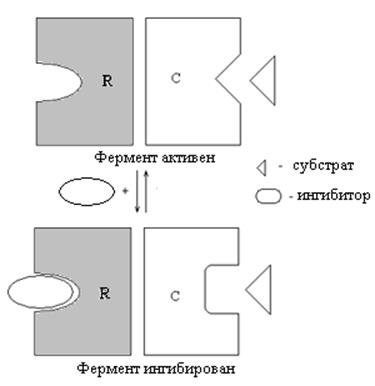
Рисунок 33 – Механизм аллостерического ингибирования фермента
Присоединение аллостерического ингибитора к аллостерическому центру приводит к изменению конформации активного центра на каталитической субъединице фермента и понижению его сродства к субстрату.
Аллостерическое ингибирование является обратимым. Диссоциация комплекса R-субъединицы с ингибитором сопровождается восстановлением исходной конформации полипептидных цепей субъединиц, в результате чего сродство активного центра к субстрату восстанавливается.
Очень часто в роли аллостерических ингибиторов выступает продукт реакции или метаболического пути, в котором участвует фермент. Процесс ингибирования фермента продуктом реакции называетсяретроингибированием.
Ретроингибирование лежит в основе механизма отрицательной обратной связи в регуляции обменных процессов и поддержании гомеостаза. За счет него обеспечивается поддержание постоянного уровня различных промежуточных продуктов обмена веществ в клетках. Примером ретроингибирования может служить ингибирование гексокиназы продуктом реакции глюкозо-6-фосфатом:

В некоторых случаях ингибирование происходит не за счет конечного продукта реакции, а конечного продукта процесса, в котором происходит реакция. Ретроингибирование фермента Е продуктом процесса Р:

где Б, В, Г, Д – промежуточные продукты.
В представленной последовательности превращений в качестве аллостерического ингибитора фермента Е выступает продукт процесса – Р. Подобный механизм ретроингибирования широко встречается в клетках. В качестве примера можно привести ингибирование фермента ацетил-КоА-карбоксилазы, принимающего участие в синтезе высших жирных кислот, конечным продуктом синтеза жирных кислот – пальмитиновой кислотой.
Аналогичным, но противоположным образом действуют на аллостерические ферменты аллостерические активаторы. В отсутствии активатора фермент имеет низкое сродство к субстрату. Однако при соединении ал-лостерического центра с активатором происходит повышение сродства каталитического центра к субстрату, что сопровождается повышением скорости превращения субстрата. В качестве аллостерических активаторов часто выступает молекула субстрата реакции. В этом заложен глубокий биологический смысл. В условиях, когда в клетке возрастает содержание субстрата, для поддержания постоянства внутренней среды появляется необходимость в его утилизации. Это достигается за счет активации фермента, который катализирует его превращение. Примером подобной активации может быть активация глюкокиназы глюкозой.
Аллостерические ферменты, у которых субстрат выступает в роли активатора называются гомотропными. На этих ферментах имеется несколько одинаковых по строению центров связывания субстрата, которые в зависимости от условий могут выполнять функцию и регуляторных, и каталитических центров фермента.
Как противоположность гомотропным ферментам существуют гетеротропные энзимы. Последние регулируются модуляторами, структура которых отличается от субстрата. Поэтому в их структуре выделяются существенно различающиеся по строению активный и аллостерическийцентры.
Очень часто один и тот же аллостерический фермент оказывается способным взаимодействовать с несколькими различными модуляторами – активаторами и ингибиторами. В качестве примера можно привести фермент – фосфофрктокиназу (ФФК), которая катализирует следующую реакцию:

При этом разные модуляторы, как правило, имеют свои участки связывания на молекуле фермента.
Кинетика гомотропных ферментов отличается от кинетики неаллостерических энзимов. График зависимости скорости реакции от концент-рации субстрата имеет у них не гиперболическую, а сигмовидную форму (рис. 34).
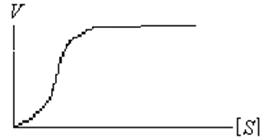
Рисунок 34 – Кинетика гомотропных ферментов
По этой причине для расчета Км у них неприемлемо уравнение Михаэлиса-Ментен.
Сигмовидный характер кинетики аллостерических ферментов связан с особым – кооперативным характером взаимодействия отдельных субъединиц энзима с субстратом. Связывание каждой следующей молекулы субстрата с участком связывания способствует возникновению конформационных перестроек в соседних субъединицах, следствием чего становится повышение их сродства к субстрату.
Изоферменты
Важное значение в обеспечении эффективного течения обменных процессов в клетках имеют изоферменты. Изоферменты представляют собой генетически детерминированные множественные формы фермента, катализирующие одну и ту же реакцию, но имеющие разную структуру и физико-химические свойства.
Типичным ферментом, который представлен изоферментами, является лактатдегидрогеназа (ЛДГ). Этот энзим катализирует следующую реакцию.

При электрофорезе сыворотки крови человека в крови выявляется пять различных белковых фракций, которые обладают способностью катализировать лактатдегидрогеназную реакцию. Таким образом, можно прийти к заключению о существовании пяти изоферментов ЛДГ (рис. 35).
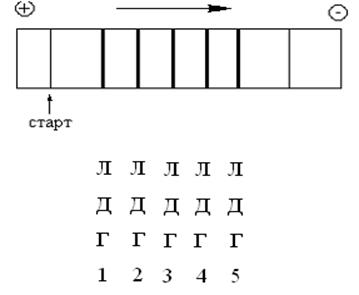
Рисунок 35 – Распределение изоферментов ЛДГ на электрофорерограмме (электрофорез проводится при рН 6,8)
Важное значение в объяснении феномена существования изоферментов имеет тот факт, что изоферменты встречаются только у ферментов – олигомерных белков. Их молекула состоит не меньше чем из двух субъединиц.
Что касается ЛДГ, то этот фермент представляет собой тетрамер, т.е. в его молекулу входит четыре отдельные субъединицы. При этом существует два различных типа субъединиц ЛДГ – М-тип (мышечный) и Н-тип (сердечный). Субъединица представляет собой полипептидную цепь, структура которой кодируется соответствующим геном, что и предопределяет генетическую природу изоферментов. В виду того что полипептиды субъединиц являются продуктами разных генов, они имеют:
· различный аминокислотный состав (первичную структуру);
· неодинаковые физико-химические свойства (электрофоретическую подвижность);
· особенности синтеза в разных тканях.
Ввиду различий в структуре изоферменты различаютсяи и по кинетике (сродству к субстрату), особенностям регуляции активности, а также локализации в клетках эукариот и тканевой специфичности в высших организмах.
В состав тетрамера молекулы ЛГД могут входить разные типы субъединиц в различных соотношениях. При образовании тетрамера возможна следующая комбинация субъединиц:

По этой причине становится понятной причина существования именно пяти изоферментов ЛДГ: ЛДГ1 имеет минимальную электрофоретическую подвижность, а ЛДГ5 – максимальную.
Гены изоферментов ЛДГ по-разному экспрессируются в различных тканях: в сердечной мышце синтезируется только субъединица Н-типа. Поэтому здесь образуется только ЛДГ1, которая состоит исключительно из этого типа суъединиц. В печени и скелетных мышцах синтезируется только суъединица М-типа. Поэтому здесь образуется и функционирует только изофермент ЛДГ5, состоящий исключительно из М-субъединиц. В остальных тканях с разной скоростью экспрессируются гены, кодирующие и Н-, и М-субъединицы. Поэтому в них могут образовываться различные промежуточные формы изоферментов ЛДГ (ЛДГ2–ДГ4).
Ввиду того что субъединицы различаются по аминокислотному составу, они обладают неодинаковой молекулярной массой и электрическим зарядом. Это обусловливает их различные физико-химические свойства.
Помимо различий физико-химических свойств, изоферменты сильно различаются по каталитическим свойствам (по кинетическим параметрам: для них характерна различная величина числа оборотов (Vmax) и сродства к субстрату (Км), а также по чувствительности к действию различных регуляторов).
Так, у ЛДГ1 величина Км по отношению к молочной кислоте составляет 0,0044 М, тогда как у ЛДГ5 – 0,0256 М. Мочевина проявляет свойства ингибитора в отношении ЛДГ5 , но не оказывает влияния на ЛДГ1. При этом в качестве ингибитора ЛДГ1 выступает пировиноградная кислота, которая не оказывает аналогичного эффекта на ЛДГ5 .
Таким образом, изоферменты различают по структуре и свойствам, а их существование генетически детерминировано. При этом возникает вопрос о биологической целесообразности изоферментов.
Для того чтобы разобраться в данном вопросе необходимо иметь ввиду, что в различных отделах (компартментах) клетки эукариот, а также в разных тканях многоклеточного организма, существуют различные условия. В них содержится неодинаковая концентрация одних и тех же субстратов и кислорода. Для них характерна различная величина рН и ионный состав. Поэтому в клетках разных тканей, а также в разных компартментах клетки одни и те же химические превращения фактически протекают в неодинаковых условиях. В этой связи существование изоферментов, обладающих различиями в каталитических и регуляторных свойствах, позволяет
1) осуществлять одни и те же химические превращения с одинаковой эффективностью в разных условиях;
2) обеспечивать тонкую регуляцию каталитических превращений в соответствии с особенностями распределения регуляторов в соответствующем компартменте клетки и разных тканях.
Указанное может быть проиллюстрировано особенностями свойств цитоплазматического и митохондриального изоферментов карбамоилфосфатсинтазы. Этот фермент катализирует реакцию синтеза карбамоилфосфата.

Карбамоилфосфат, образующийся в митохондриях, под действием митохондриального изофермента далее вовлекается в процесс образования мочевины, а карбамоилфосфат, образующийся под влиянием цитоплазматического изофермента, затем используется для синтеза пиримидиновых нуклеотидов. Естественно, что эти ферменты, связанные с совершенно различными обменными процессами, разделены пространственно и имеют различные каталитические и регуляторные свойства. Их присутствие в одной клетке позволяет одновременно происходить двум разным процессам, связанным с использованием одного предшественника.
Таким образом, существование изоферментов имеет важное биологическое значение, связанное с возможностью течения одних и тех же ферментативных процессов в разных условиях и по этой причине генетически детерминировано.
Контрольные вопросы
1. В чем заключается сходство и различие между ферментами и небелковыми катализаторами?
2. Перечислите основные классы ферментов и охарактеризуйте их.
3. На чем основана современная международная номенклатура ферментов?
4. Дайте определение понятия энергетический барьер реакции.
5. Какие существуют взгляды на механизм понижения ферментами энергетического барьера реакции?
6. В чем заключается физический смысл константы Михаэлиса и максимальной скорости реакции?
7. В каких единицах измеряется константа Михаэлиса и максимальная скорость реакции?
8. Почему при повышении температуры реакционной смеси до температурного оптимума скорость ферментативной реакции возрастает?
9. Какие виды специфичности ферментов вам известны? С чем связана специфичность ферментов?
10. Почему активность ферментов зависит от рН среды? Активность каких ферментов в большей мере зависит от этого фактора?
11. Какие методы количественного определения ферментов вам известны?
12. В чем измеряется активность ферментов?
13. В чем заключаются принципиальные различия между обратимыми и необратимыми ингибиторами?
14. Что такое конкурентные ингибиторы? Какие конкурентные ингибиторы вам известны?
15. Каков механизм аллостерического ингибирования?
16. В чем заключается биологическая целесообразность существования изоферментов?
17. Какие методы фракционирования изоферментов вам известны?
Глава 6. ВИТАМИНЫ
Витаминами называются органические вещества, которые в малых количествах необходимы для обеспечения нормального обмена веществ и физиологических функций, не синтезируются в организме и являются обязательными компонентами пищи.
Необходимость витаминов для обеспечения жизнедеятельности организма связана с тем, что большинство из них участвует в образовании коферментов. Ввиду того что для обеспечения нормального течения каталитических процессов требуются очень небольшие количества ферментов, которые к тому же не расходуются в процессе химических реакций, витамины тоже необходимы организму в очень небольших количествах.
В настоящее время известно более 20 витаминов. Основными их источниками являются:
· пища животного и растительного происхождения;
· сапрофитная микрофлора толстого кишечника;
· провитамины.
Провитамины представляют собой предшественники витаминов, из которых в организме различными путями происходит образование активных витаминов. К их числу относятся каротин (провитамин А), 7-дегидро-холестерин (провитамин D) и др.
Помимо витаминов, выделяется особая группа витаминоподобных веществ. Эти вещества обладают свойствами витаминов, но синтезируются в организме человека. К ним относятся карнитин, инозитол, липоевая кислота, холин, пангамовая кислота, витамин U и др. Витаминоподобные вещества проявляют свойства витаминов у соответствующих видов организмов.
Наряду с витаминами существует группа веществ – антагонистов, которые обозначаются термином антивитамины. К ним относятся вещества, которые проявляют действие, противоположное действию витаминов.
Антивитамины можно условно подразделить на две группы в зависимости от механизма их антивитаминного эффекта.
1. Ферменты, разрушающие витамины. Примером представителей этой группы могут служить тиаминаза (фермент, катализирующий превращения витамина В1 ), аскорбатоксидаза (фермент, катализирующий превращения витамина С) и т.д.
2. Вещества, обладающие сходной с витаминами структурой, за счет чего способные вступать с витаминами в конкурентные отношения за общие участки связывания. В эту группу входят и производные витаминов (окситиамин и др.).
Потребность в витаминах зависит от множества различных причин. К ним относятся пол, возраст, время года, географическая широта обитания, физическое состояние, характер труда, состояние здоровья и др.
В том случае, когда возникает нарушение соответствия между потребностью организма в витамине и уровнем его поступления в организм, наступает состояние витаминного дисбаланса. Проявлением витаминного дисбаланса могут служить:
· гиповитаминозы;
· авитаминозы;
· гипервитаминозы.
Гиповитаминозы представляют собой состояния, при которых уменьшается содержание витамина в организме. Существует две основные группы причин (внешние и внутренние), которые приводят к их возникновению.
1. К внешним относятся причины, которые приводят к снижению поступления витаминов в организм с пищей (голодание, употребление в пищу продуктов, содержащих малое количество витаминов или подвергнутых неправильной кулинарной обработке).
2. Внутренние причины связаны с увеличением потребности организма в витаминах при определенных состояниях (детский возраст, беременность, тяжелый физический труд, при стрессе и различных внутренних заболеваниях) или с нарушением усвоения витаминов в организме (при различных заболеваниях, связанных с поражением желудочно-кишечного тракта).
Гиповитаминозы имеют довольно широкое распространение. Особенно часто они встречаются в весенний период года.
Авитаминозы представляют собой крайнюю форму гиповитаминозов. Они характеризуются исчезновением из организма отдельных витаминов. Чаще всего причиной авитаминозов служит прекращение поступления витаминов в организм с пищей. В настоящее время это состояние встречается довольно редко. Оно может возникать у тех контингентов людей, которые работают в экстремальных условиях (военные, геологи, моряки и др.).
Гипервитаминозы представляют собой состояния, при которых увеличивается содержание витаминов в организме. Причиной их возникновения чаще всего служит увеличение поступления витаминов с пищей. Наиболее характерно возникновение гипервитаминозов для жирорастворимых витаминов. Оно может возникать при длительном употреблении в пищу продуктов, богатых определенными витаминами, а также от передозировки витаминных препаратов.
Классификация витаминов
В основу современной классификации витаминов положена их раст-воримость. По этому признаку все витамины подразделяются на:
· жирорастворимые– витамины А, D, Е, К, F, Q;
· водорастворимые – витамины группа В (В1, В2, В3, В5, В6, В12, Вс), а также РР, С, Н и рутин.
Жирорастворимые витамины
Для этой группы витаминов характерен целый ряд общих свойств:
1. В структуру многих жирорастворимых витаминов входят остатки молекул изопрена. Они соединяются друг с другом в цепи определенной длины, которые во многом и определяют нерастворимость жирорастворимых витаминов в воде и наоборот – хорошую растворимость в органических растворителях:

Изопрен
2. Для обеспечения всасывания жирорастворимых витаминов необходимо наличие достаточного количества желчных кислот в кишечнике, а также достаточное содержание жиров, как их растворителей, в пище.
3. Ввиду того что жирорастворимые витамины нерастворимы в воде, они переносятся в организме кровью с помощью особых белковых переносчиков. Как правило, каждый витамин переносится своим белком-переносчиком.
4. Жирорастворимые витамины способны накапливаться в тканях внутренних органов. В качестве их “депо” наиболее часто выступает ткань печени. Прекращение поступления жирорастворимых витаминов с пищей не сразу приводит к возникновению гиповитаминоза. Это связано с тем, что организм в течение некоторого времени способен обеспечиваться ими из собственных “депо”.
5. Для большинства жирорастворимых витаминов, не характерна коферментная функция.
6. Биологическая роль жирорастворимых витаминов связана с тем, что они обладают способностью регулировать экспрессию генов.
Однако, несмотря на определенные сходства, жирорастворимые витамины обладают существенными особенностями в проявлении своего биологического эффекта.
Витамин А
|
Просмотров 3790 |
|
|
